
PATHOLOGY OF THE URINARY SYSTEM
Dr. Ameer Dhahir
Part one
Objectives:
Defining certain clinical terms related to urinary
disorders.
Describing the pathogenesis of glomerular diseases
Defining certain clinical syndromes related to
glomerular pathology and these include:
o Nephrotic syndrome
o Nephritic syndrome
o Chronic glomerulonephritis
Highlighting their pathological features
Mentioning certain tubulointerstitial disorders:
o Tubulointerstitial nephritis
Acute pyelonephritis
Chronic pyelonephritis
o Drug induced interstitial nephritis
o Acute tubular necrosis
Mentioning their pathogenesis and the most
important pathological features
Describing the pathogenesis of renal blood vessels
disorders
INTRODUCTION
Diseases of the kidney are divided into four categories depending on which
component of the kidney is primarily affected; these are
1. Glomerular 2. Tubular 3. Interstitial 4. Vascular
This division is useful because
a. The early manifestations of each group of diseases tend to be distinctive.
b. These groups differ in their pathogenesis, for e.g., glomerular diseases are often
immunologically mediated, whereas tubular and interstitial disorders are more likely
to be caused by toxic or infectious agents. However, it should be noted that
1. The interdependence of renal components translated into that damage to one
component is almost always affects secondarily the others.
2. All forms of chronic renal disease tend ultimately to damage all four components of
the kidney thus, eventuates in chronic renal failure (end-stage kidney disease).

Clinical Manifestations of Renal Diseases
These can be grouped into well-defined syndromes, each of which is distinctive to the
component that is primarily affected.
At this point certain terms need to be clarified
Azotemia: is an "elevation of blood urea, nitrogen and creatinine levels". It is largely
related to a decreased glomerular filtration rate (GFR). Azotemia is divided into
1. Prerenal azotemia, encountered with hypoperfusion of the kidneys, which decreases
GFR as in shock states
2. Renal, which is due to renal par benchymal damage
3. Postrenal that results from urine out flow obstruction below the level of the kidney.
Uremia: signifies
"azotemia associated with
biochemical
and systemic
clinicopathological alterations" such as metabolic and endocrine changes, uremic
gastroenteritis, peripheral neuropathy and fibrinous pericarditis.
The major renal syndromes are
Acute nephritic syndrome: is characterized by acute onset of usually gross
hematuria, mild to moderate proteinuria, azotemia, edema, and hypertension; it
is the classic presentation of acute poststreptococcal glomerulonephritis.
The nephrotic syndrome: is characterized by heavy proteinuria (excretion of >3.5
gm of protein/day in adults), hypoalbuminemia, severe edema, hyperlipidemia,
and lipiduria.
Asymptomatic (microscopic) hematuria or proteinuria, or a combination thereof,
is usually a manifestation of mild glomerular abnormalities.
Acute renal failure refers to recent onset of oliguria or anuria, with azotemia.
Chronic renal failure refers to prolonged symptoms and signs of uremia; it is the end
result of all chronic renal diseases.
Urinary tract infection (UTI) is characterized by bacteriuria and pyuria (bacteria
and leukocytes in the urine. The infection may be symptomatic or asymptomatic, and
may affect the kidney (pyelonephritis) or the bladder (cystitis) only.
Nephrolithiasis (renal stones) is manifested by renal colic, hematuria, and recurrent
stone formation.
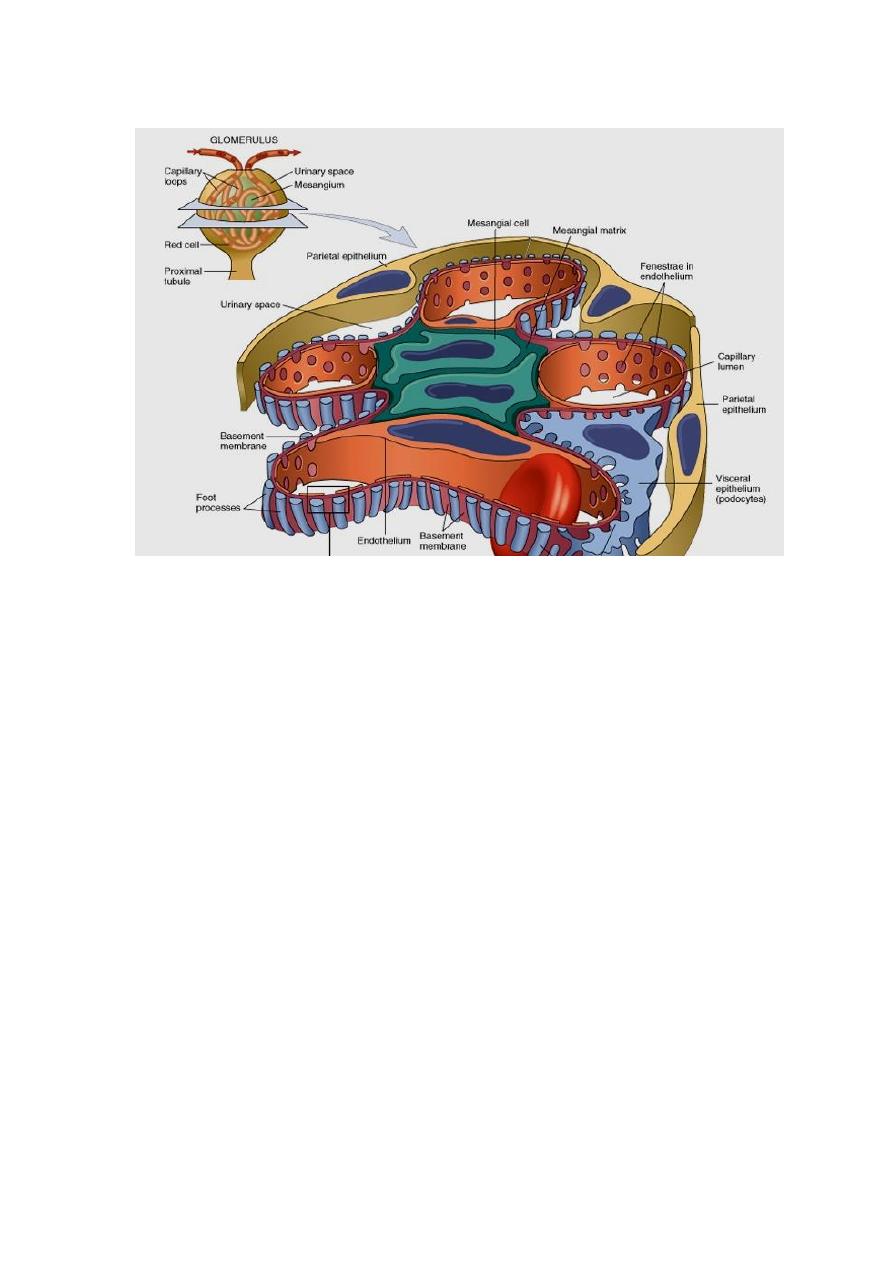
GLOMERULAR DISEASES
The glomerular basement membrane shows selective permeability, which is size-
dependent and charge-dependent. The major characteristics of glomerular filtration
are
1. A high permeability to water and small solutes
2. Almost complete impermeability to molecules of the size and molecular charge of
albumin.
3. More permeability to cations than anions.
The podocyte is decisive to the glomerular barrier function by providing a distal
resistance to the flow of water and a barrier to the filtration of proteins. It is also
largely responsible for synthesis of GBM components.
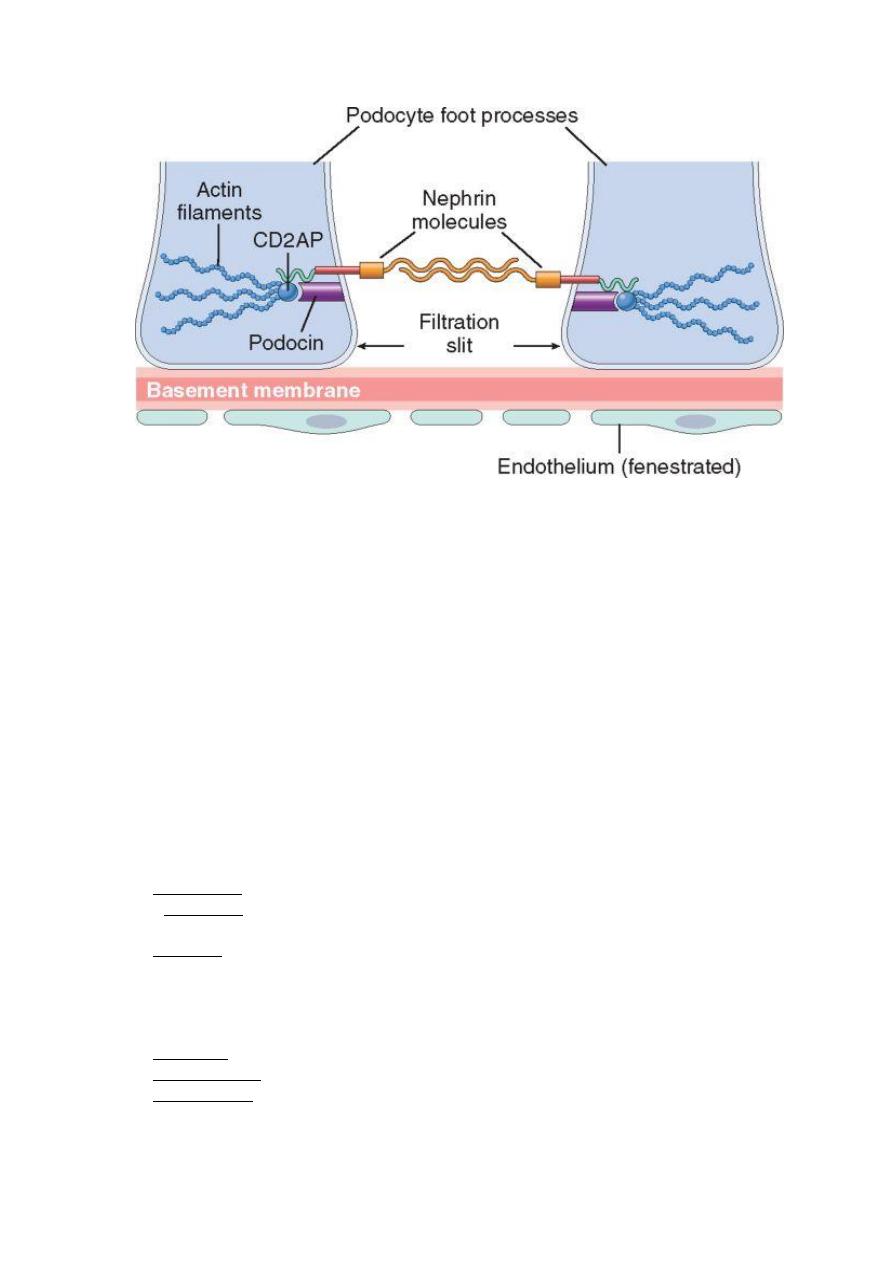
PATHOGENESIS OF GLOMERULAR DISEASES IN GENERAL
Immune mechanisms (antibody-associated & cellular) underlie most primary and
many secondary glomerular diseases. : the following immune mechanism are
important:
Circulating Immune Complex
Cell-Mediated Immune Glomerulonephritis
In Situ Immune Complexes
Other Mechanisms( podocyte injury and nephron loss)
Circulating Immune Complex-mediated Nephritis (type III hypersensitivity
reactions)
With circulating immune complex-mediated disease, the glomerulus is an "innocent
bystander" because it is not responsible for their formation. The antigen in these
complexes may be
1. Endogenous, as in SLE or
2. Exogenous, as in bacterial (streptococcal), viral (hepatitis B), parasitic
(Plasmodium falciparum malaria), and spirochetal (Treponema pallidum) infections.
3. Unknown as often the case in membranous nephropathy.
The antigen-antibody complexes are trapped in the glomeruli, where they produce
injury, mainly through the activation of complement and the recruitment of
leukocytes. Electron microscopy reveals the immune complexes as electron-dense
deposits or clumps that are:
1. Mesangial
2. Subendothelial i.e. between the endothelial cells and the GBM
3. Subepithelial i.e. at the outer surface of the GBM and the podocytes
The presence of immunoglobulins and complement in these deposits can be
demonstrated by immunofluorescence microscopy. When fluoresceinated anti-
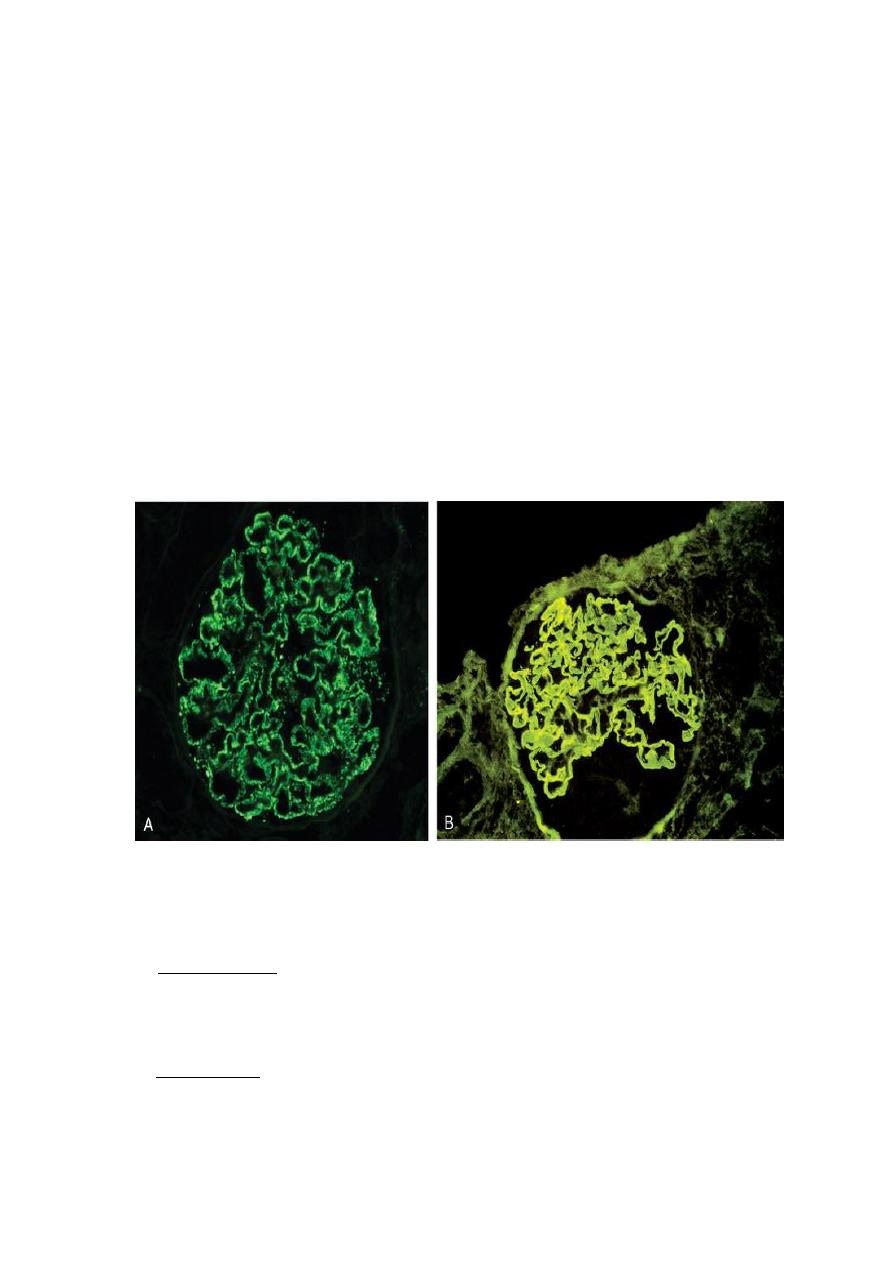
immunoglobulin or anti-complement antibodies are used, the immune complexes are
seen as granular deposits in the glomerulus.
Cell-Mediated Immune Glomerulonephritis
T cell-mediated injury may account for some cases of glomerulonephritis (GN) in
which either there are no deposits of antibodies or immune complexes, or the deposits
do not correlate with the severity of damage.
Nephritis Caused by In Situ Immune Complexes
Antibodies in this form of injury react directly with planted antigens in the
glomerulus. The best-characterized disease in this group is anti-GBM antibody GN.
It results from the formation of autoantibodies directed against the GBM. Deposition
of these antibodies creates a linear pattern of staining when visualized with
immunofluorescence microscopy; this is in contrast to the granular pattern described
for other forms of immune complex-mediated nephritis. Sometimes, the anti-GBM
antibodies cross-react with basement membranes of lung alveoli, resulting in
combined lung and kidney lesions (Goodpasture syndrome). Planted antigens also
include DNA, bacterial products, aggregated IgG, which deposit in the mesangium
because of their size.
Two patterns of deposition of immune complexes as seen by immunofluorescence microscopy. A,
Granular, characteristic of circulating and in situ immune complex deposition. B, Linear,
characteristic of classic anti-GBM antibody GN.
Other Mechanisms of Glomerular Injury
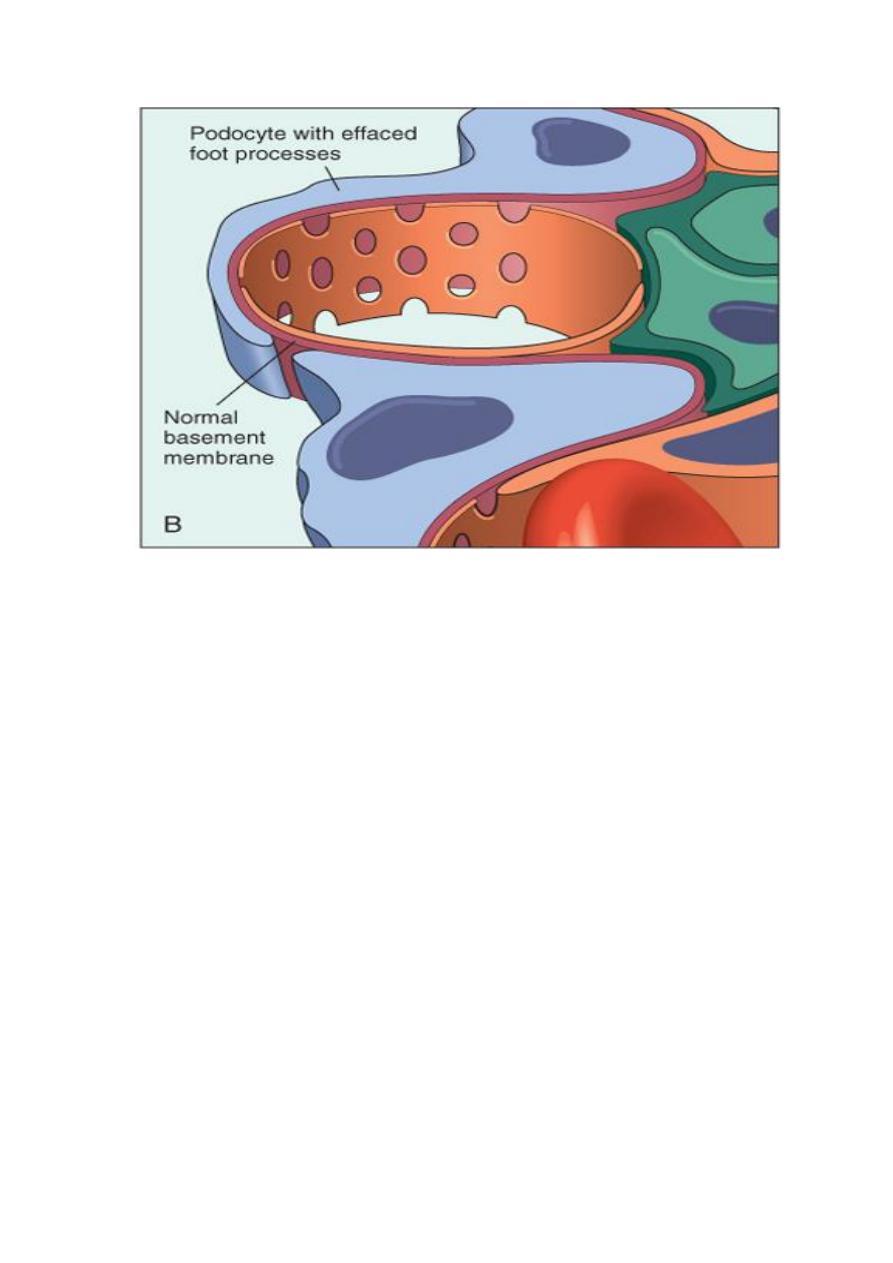
1. Podocyte injury: this can be induced by antibodies to visceral epithelial cell
antigens as in some cases of focal and segmental glomerulosclerosis. Such injury is
reflected by effacement of podocyte's foot processes associated with proteinuria. In
most forms loss of normal slit diaphragms is a key feature in the development of
proteinuria.
2. Nephron Loss: any renal disease destroying sufficient nephrons to the extent of
reducing the GFR to 30%-50% of normal shows relentless progression to end-stage
renal failure. Such individuals develop proteinuria, and their kidneys show
widespread glomerulosclerosis. The latter is initiated by the adaptive hypertrophy of
the remaining unaffected glomeruli to maintain renal function. These adaptations
ultimately lead to further endothelial and epithelial cell injury, which is followed by
capillary collapse and obliteration, increased deposition of mesangial matrix, and
eventually by segmental or global sclerosis of glomeruli. This results in further
reductions in the nephron mass and a vicious cycle of continuing glomerulosclerosis.
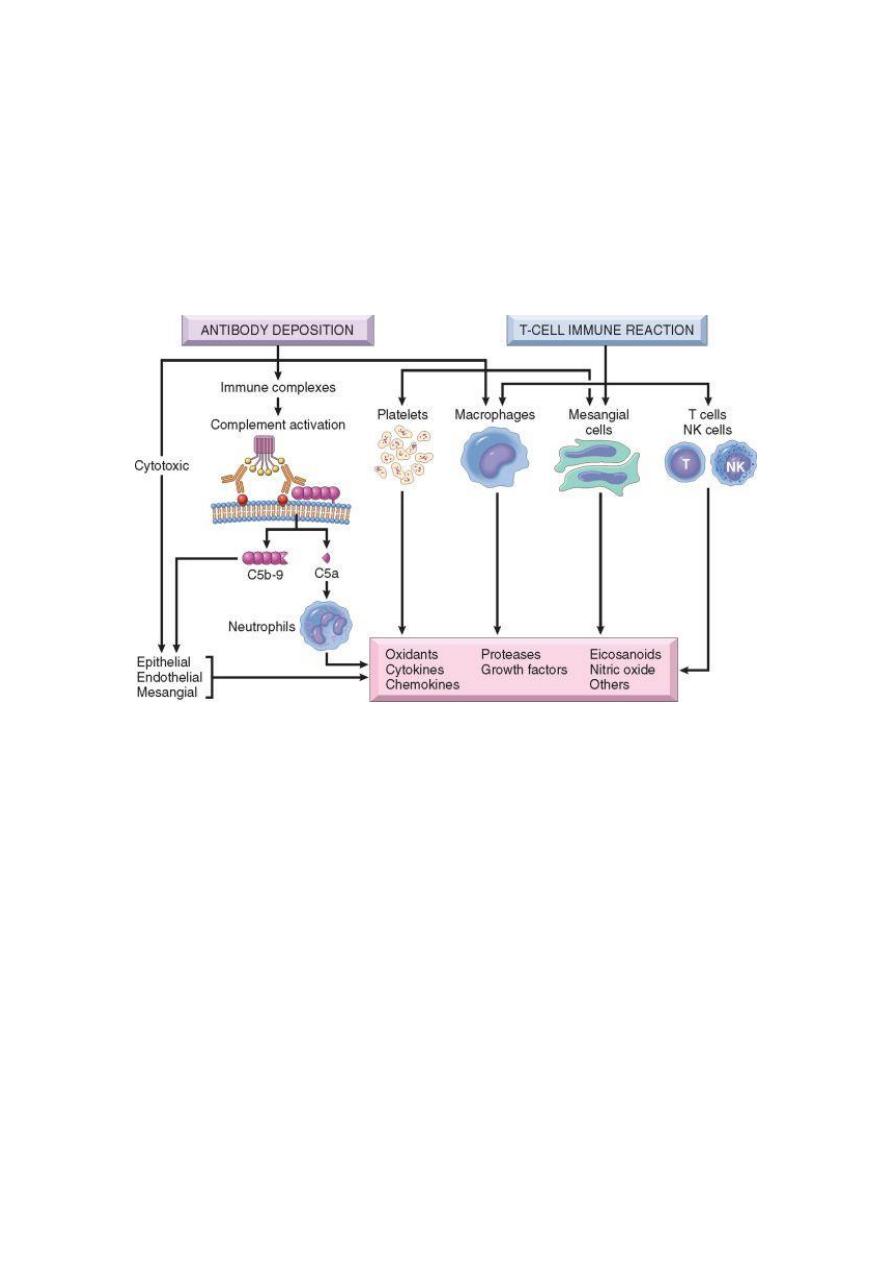
Mediators of Immune Injury:
A major pathway of antibody-initiated injury is activation of the complement that
leads to the generation of chemotactic agents (mainly C5a) and thus recruitment of
neutrophils and monocytes. Neutrophils in turn release :
1. Proteases, which cause GBM degradation;
2. Oxygen-derived free radicals, which cause cell damage; and
3. Arachidonic acid metabolites, which contribute to reduction in GFR.
In some cases, however, complement-dependent (but not neutrophil-dependent) injury
occurs through the effect of the C5-C9 lytic component (membrane attack complex)
of complement, which causes
1. Epithelial cell detachment and
2. Stimulation of mesangial and epithelial cells to secrete various mediators of cell
injury.
3. Up-regulation of transforming growth factor-β (TGF-β) receptors on podocytes;
TGF-β stimulates synthesis of extracellular matrix, thus giving rise to altered GBM
composition and thickening.
INDIVIDUAL CLINICLAL SYNDROMES:
THE NEPHROTIC SYNDROME
This refers to a clinical complex that includes
1. Massive proteinuria i.e. daily urine protein loss of 3.5 gm or more in adults

2. Hypoalbuminemia i.e. plasma albumin levels less than 3 gm/dl
3. Generalized edema
4. Hyperlipidemia and lipiduria
The initial event is a derangement in the glomerular capillary walls that leads to
increased permeability to plasma proteins allowing their escape from the plasma into
the glomerular filtrate. With long-standing or extremely heavy proteinuria, serum
albumin is decreased, resulting in hypoalbuminemia. The generalized edema is, in
turn, a consequence of the drop in plasma colloid osmotic pressure as a result of
hypoalbuminemia, and retention of salt and water by the kidney. As fluid escapes
from the vascular tree into the tissues, there is a concomitant drop in plasma volume,
with diminished glomerular filtration. Compensatory secretion of aldosterone, along
with the reduced GFR and reduction of secretion of natriuretic peptides, promotes
retention of salt and water by the kidneys, thus further aggravating the edema. By
repetition of this chain of events, generalized edema (anasarca) may develop. It is
possible that hypoalbuminemia triggers increased synthesis of lipoproteins in the liver
& thus hyperlipidemia. The lipiduria reflects the increased permeability of the GBM
to lipoproteins.
The relative frequencies of the several causes of the nephrotic syndrome vary
according to age. In children 1 to 7 years of age, the nephrotic syndrome is almost
always caused by a primary kidney disease, whereas among adults it is often due to
renal manifestations of a systemic disease.
The most frequent systemic causes of the nephrotic syndrome in adults are
1. Diabetes
2. Amyloidosis
3. SLE
The most important primary glomerular lesions that lead to the nephrotic
syndrome are
1. Minimal-change disease (MCD), which is more important in children
2.Focal and segmental glomerulosclerosis (FSGS), which is more important in adults.
3. Membranous nephropathy
4. Membranoproliferative GN
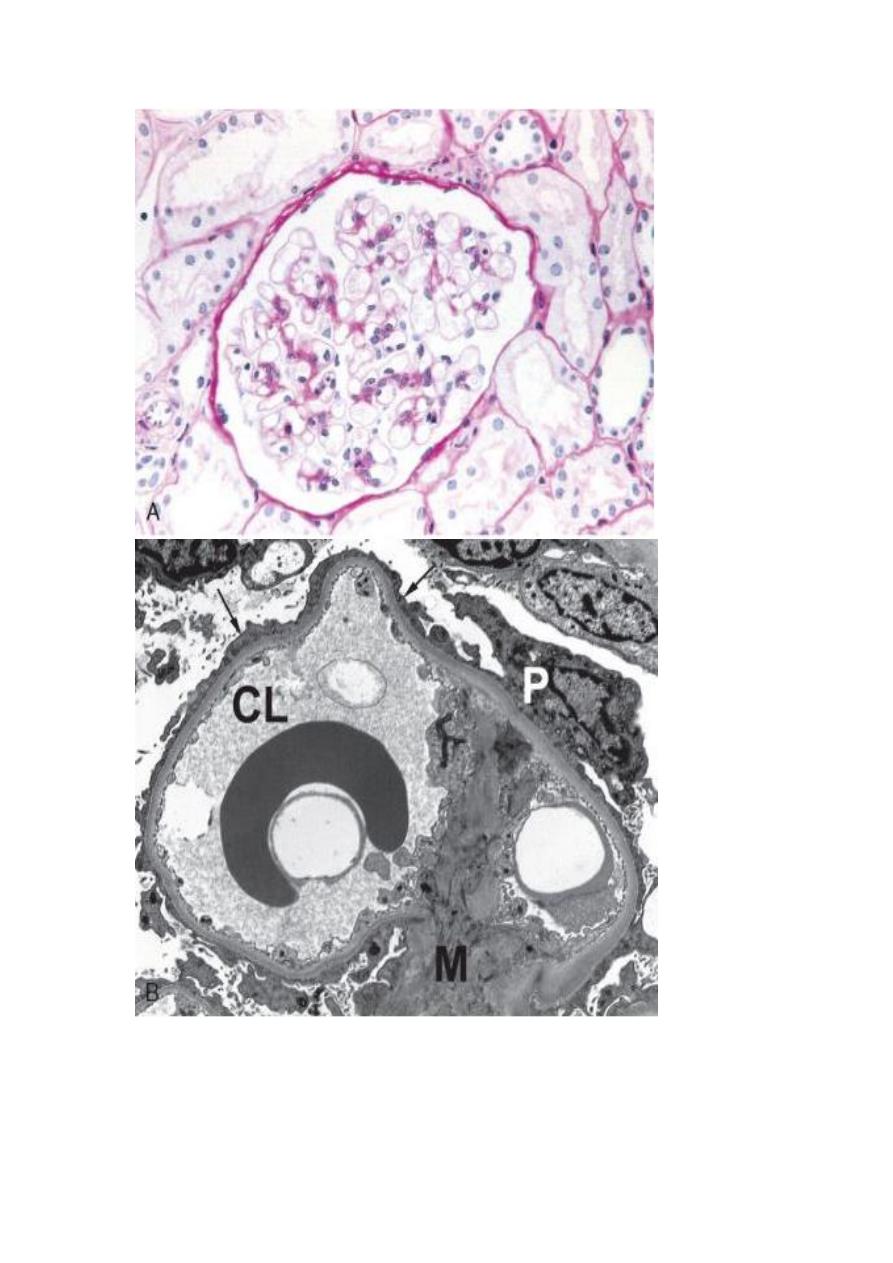
Minimal-Change Disease (MCD) (Lipoid Nephrosis)
This is the most frequent cause of the nephrotic syndrome in children, mostly between
ages 1 and 7 years (65%). The glomeruli have a normal appearance under light
microscopy; however, electron microscopy shows diffuse effacement of podocyte foot
processes. This is presumably due to a T-cell derived factor that causes podocyte
damage. The cells of the proximal convoluted tubules are often heavily loaded with
protein droplets and lipids secondary to tubular reabsorption of the leaking
lipoproteins(lipoid nephrosis). The renal function is preserved in most individuals.
The protein loss is confined to the smaller serum proteins, chiefly albumin (selective
proteinuria). The prognosis in children with this disorder is generally good; more than
90% of cases respond to a short course of corticosteroid therapy.
Focal and Segmental Glomerulosclerosis (FSGS) is characterized histologically by
sclerosis (fibrosis) affecting some but not all glomeruli (focal) and involving only
segments of each affected glomerulus (segmental). FSGS is either primary
(idiopathic) or secondary. The former is a common cause of nephrotic syndrome in
adults (30%) & frequent cause in children (10%). The secondary form is seen with
1. HIV immunodeficiency or heroin abuse (HIV nephropathy, heroin nephropathy)
2. IgA nephropathy
3. Maladaptation after nephron loss (see above)
4. Mutations affecting cytoskeletal proteins of podocytes (e.g., nephrin) (inherited
form)
Unlike MCD, there is a higher incidence of hematuria and hypertension; the
proteinuria is nonselective, and the response to corticosteroid therapy is poor. The
pathogenesis of primary FSGS is unknown. As with MCD, permeability-increasing
factors produced by lymphocytes have been proposed. The affected segment of the
glomerulus shows increased mesangial matrix, obliterated capillary lumens, and
deposition of hyaline masses. In time, progression of the disease leads to global
sclerosis of the glomeruli with secondary tubular atrophy and interstitial fibrosis.
About 50% of individuals suffer renal failure after 10 years.
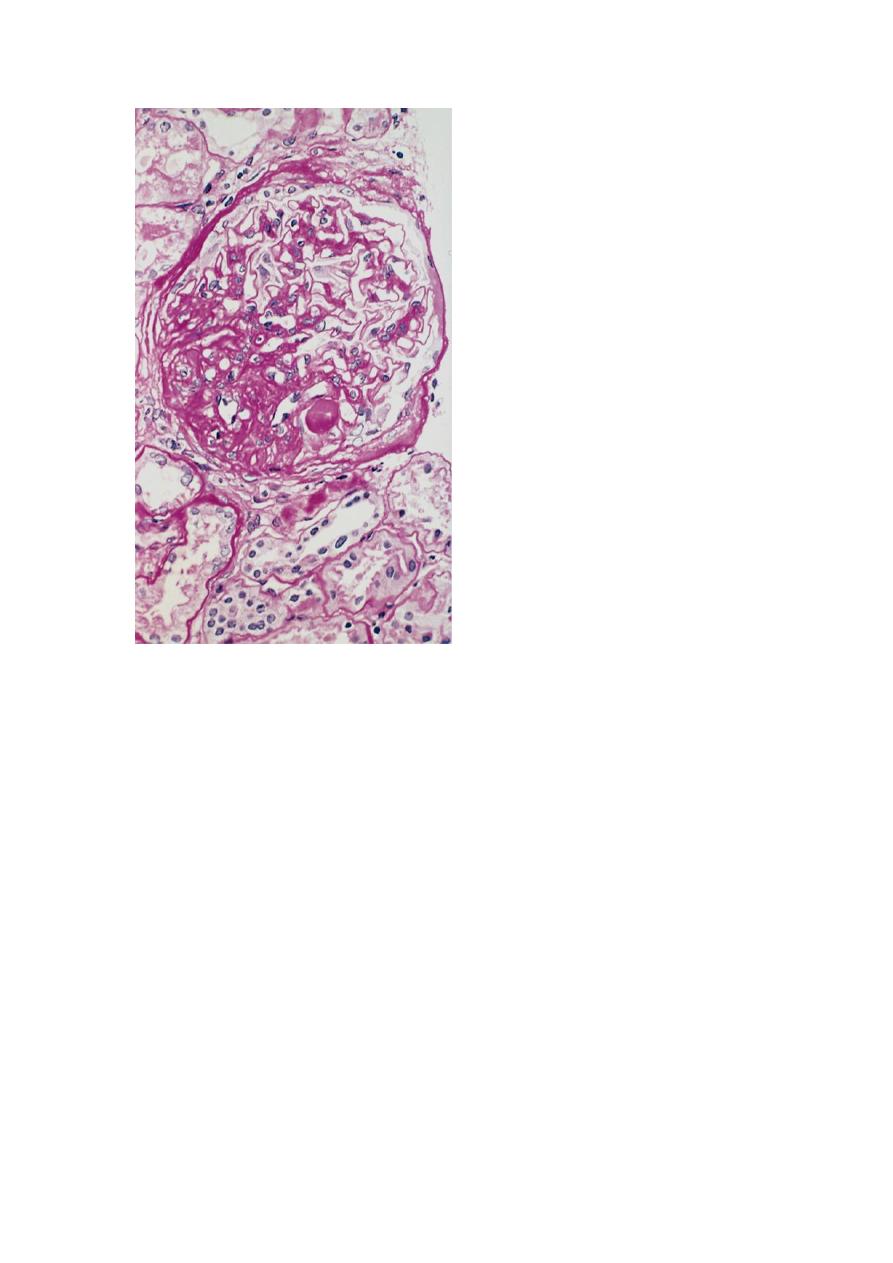
High-power view of focal and segmental glomerulosclerosis (PAS stain), seen as a mass of scarred,
obliterated capillary lumens with accumulations of matrix material, that has replaced a portion of the
glomerulus. This trichrome stain of a glomerulus in a patient with FSGS demonstrates blue collagen
deposition. FSGS accounts for about a sixth of cases of nephrotic syndrome in adults and children.
Membranous Nephropathy (Membranous Glomerulonephritis, MGN)
This is a slowly progressive disease, most common in adults 30 to 50 years of age.
The disease is idiopathic (primary) in about 85% of cases. In the remainder it may be
secondary to other disorders, including:
1. Infections (chronic hepatitis B, syphilis, schistosomiasis, malaria)
2. Malignancy, particularly lung and colonic carcinomas and melanoma
3. Autoimmune diseases e.g. SLE
4. Exposure to inorganic salts (gold, mercury)
5. Drugs (penicillamin, captoril, NSIAD)
MGN is a chronic immune complex nephritis. Most idiopathic forms are considered
autoimmune disease caused by antibodies to renal GBM autoantigen. The basic
change microscopically is diffuse thickening of the GBM. Eventually the glomeruli
become gradually sclerosed. The proteinuria is nonselective, involving globulins and
albumin molecules. Overall, only 40% suffer progressive disease terminating in renal
failure after 2 to 20 years.
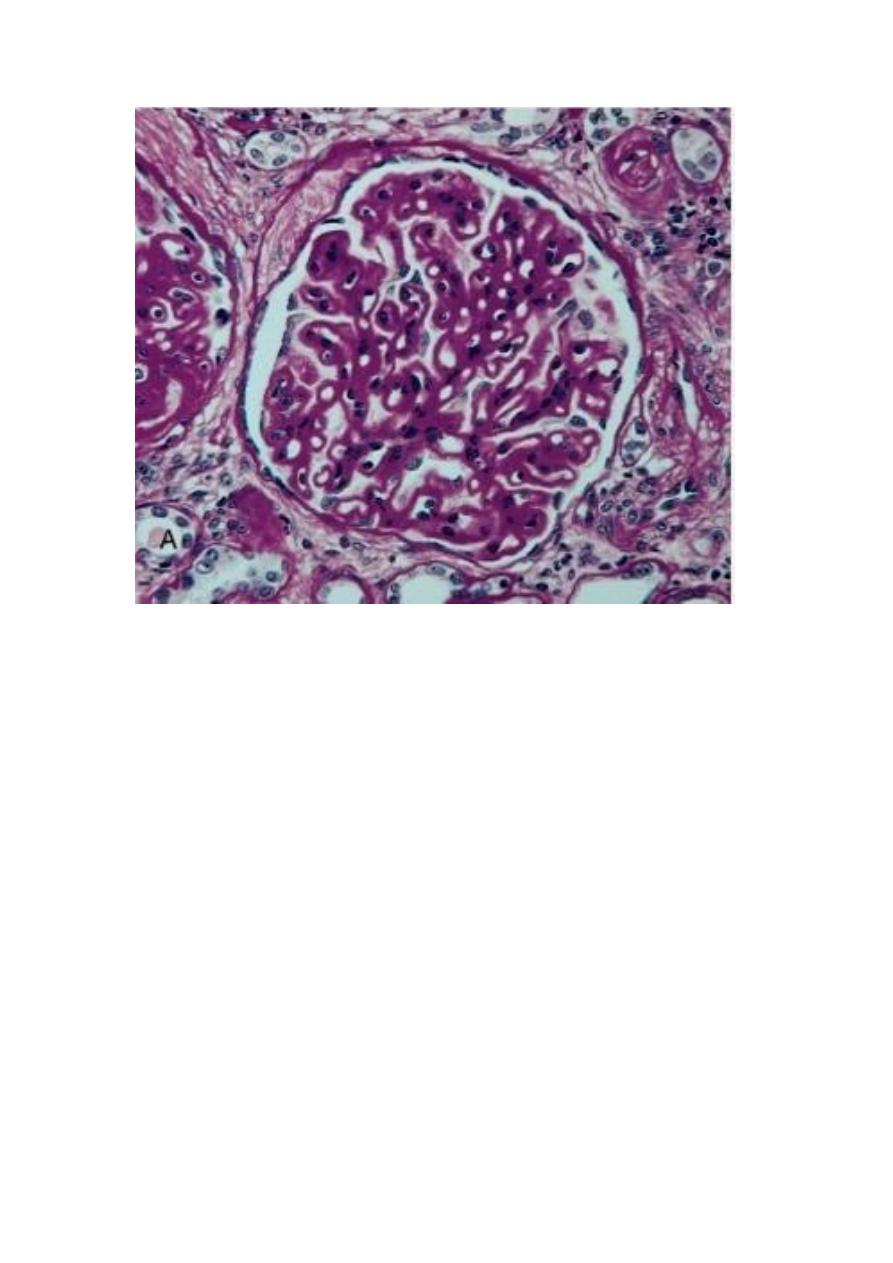
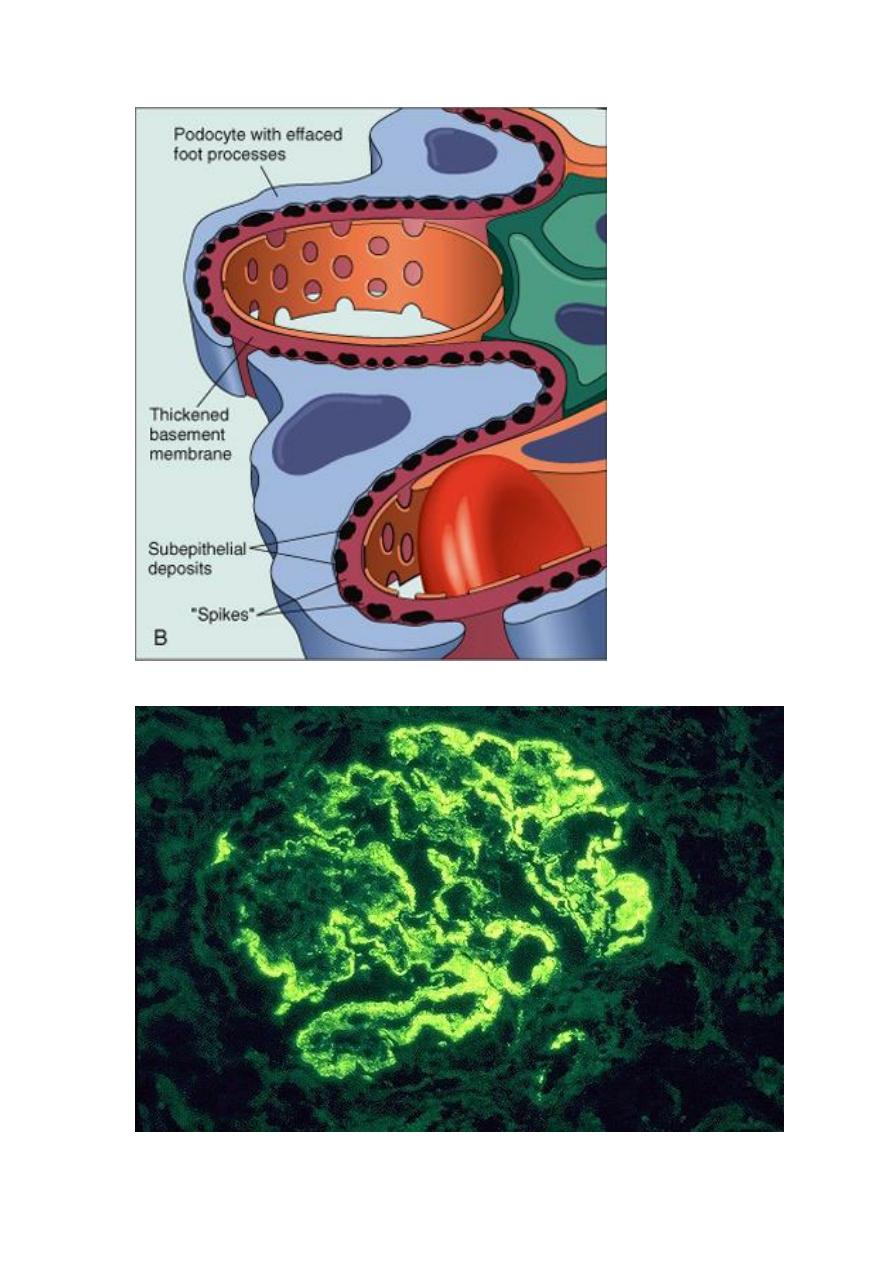
A, Diffuse thickening of the glomerular basement membrane. B, Schematic diagram illustrating
subepithelial deposits, effacement of foot processes, and the presence of "spikes" of basement membrane
material between the immune deposits.
Immunofluorescence appearance of MGP.
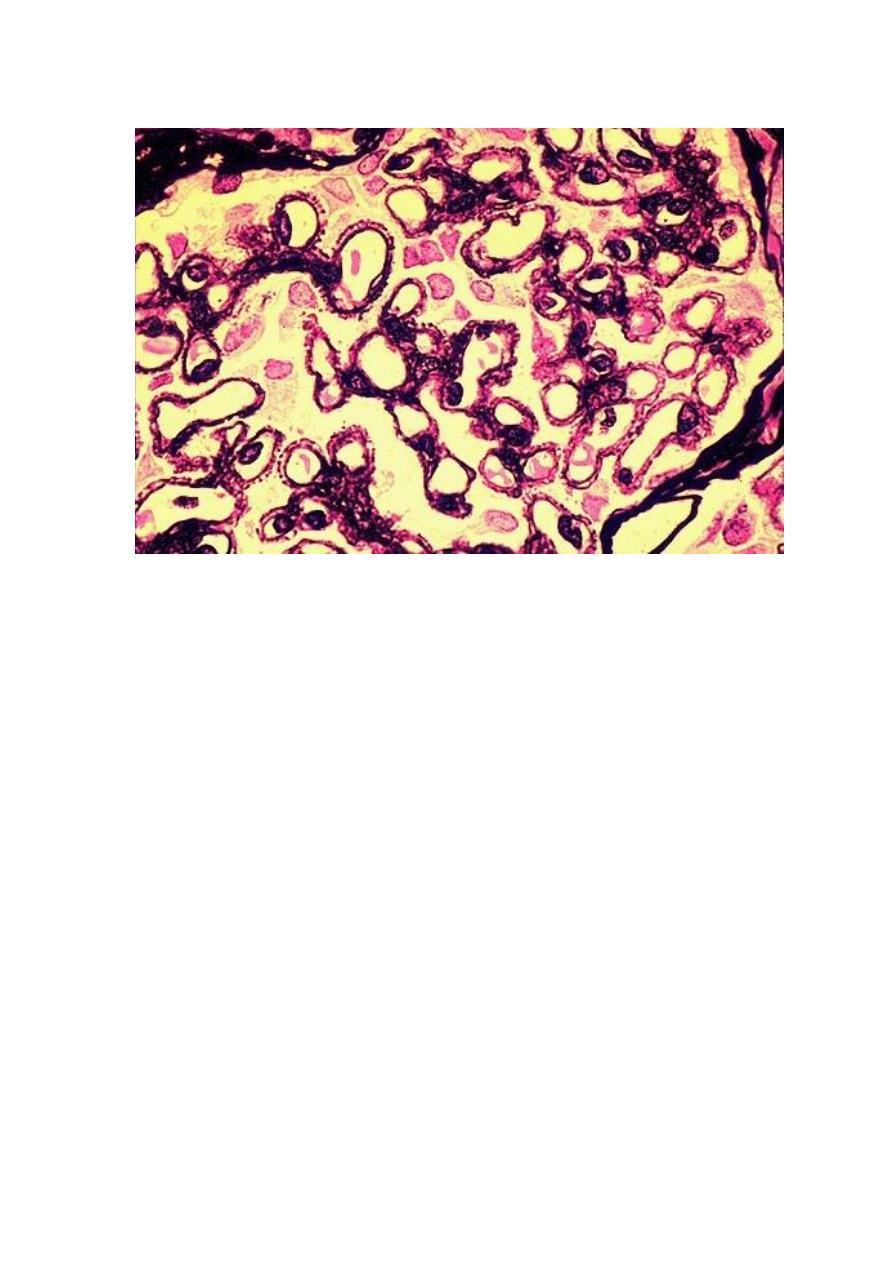
A silver stain of the glomerulus highlights the proteinaceous basement membranes in black. There are
characteristic "spikes" seen with membranous glomerulonephritis seen here in which the black basement
membrane material appears as projections around the capillary loops.
Membranoproliferative Glomerulonephritis (MPGN)
This is manifested histologically not only by GBM thickening but also by
proliferation of glomerular cells. It accounts for up to 10% of cases of primary
nephrotic syndrome in children and adults. Some individuals present only with
hematuria or subnephrotic proteinuria; others have a combined nephrotic-nephritic
picture. Two major types of MPGN (I and II) are recognized:
Type I is far more common (80% of cases). Different pathogenic mechanisms are
involved in the development of type I and type II disease. Most cases of type I MPGN
seem to be caused by circulating immune complexes, but the inciting antigen is not
known (primary); it also occurs as a secondary form in association with hepatitis B
and C antigenemia, SLE, & extra-renal infections.
The fundamental abnormality in type II appears to be excessive complement
activation.
By light microscopy, both types of MPGN are similar. The glomeruli are large, with
an accentuated lobular appearance, and proliferation of mesangial and endothelial
cells as well as leukocytic infiltration. The GBM is thickened, and the glomerular
capillary wall often shows a double contour, due to the inclusion within it of
processes of mesangial and inflammatory cells. Types I and II have different
ultrastructural and immunofluorescence microscopic features. The prognosis of
MPGN is generally poor in that 40% of the cases progressed to end-stage renal
failure. Type II MPGN (also called dense-deposit disease) has a worse prognosis.
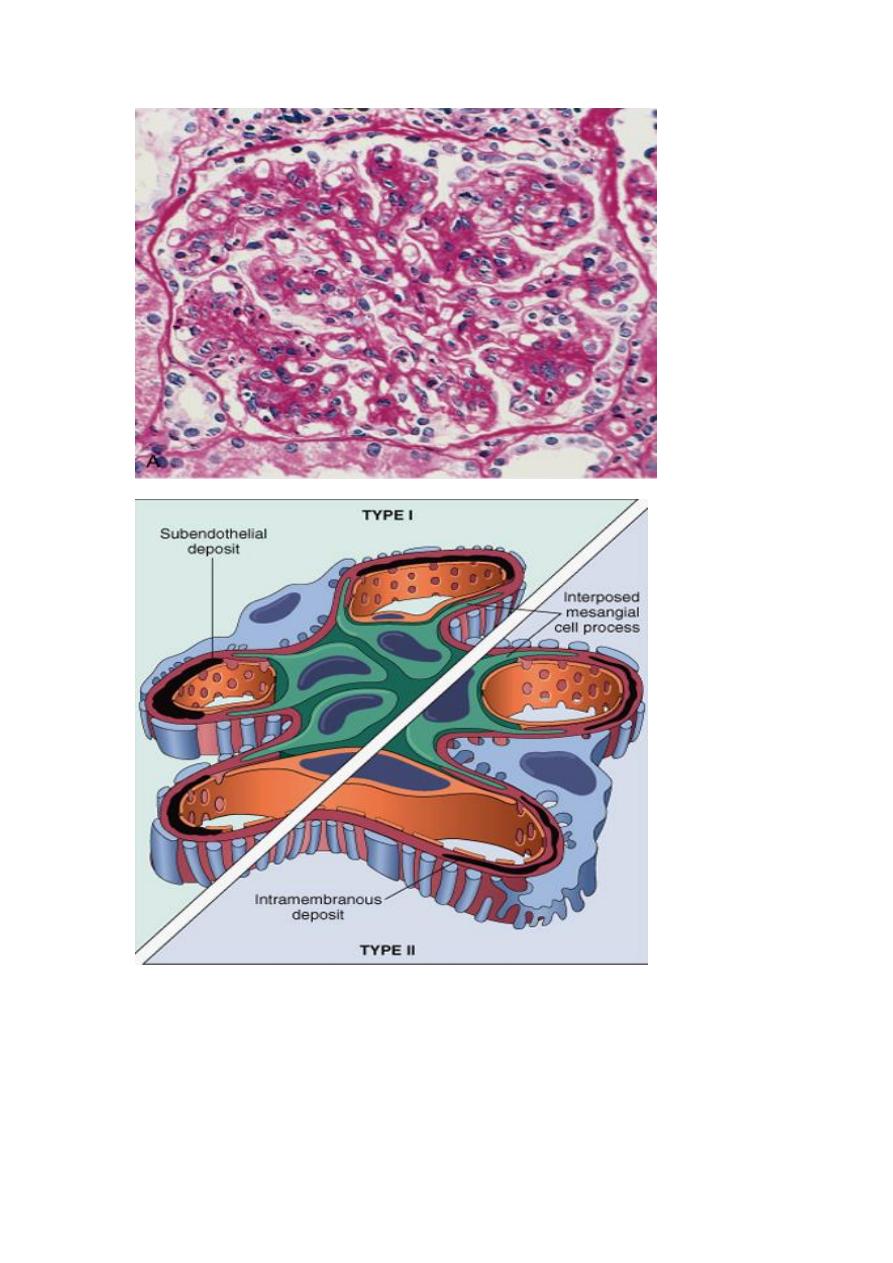
A, showing mesangial cell proliferation, basement membrane thickening, leukocyte infiltration, and
accentuation of lobular architecture. B, Schematic representation of patterns in the two types of
membranoproliferative GN. In type I there are subendothelial deposits; type II is characterized by
intramembranous dense deposits (dense-deposit disease). In both, mesangial interposition gives the
appearance of split basement membranes when viewed by light microscopy.
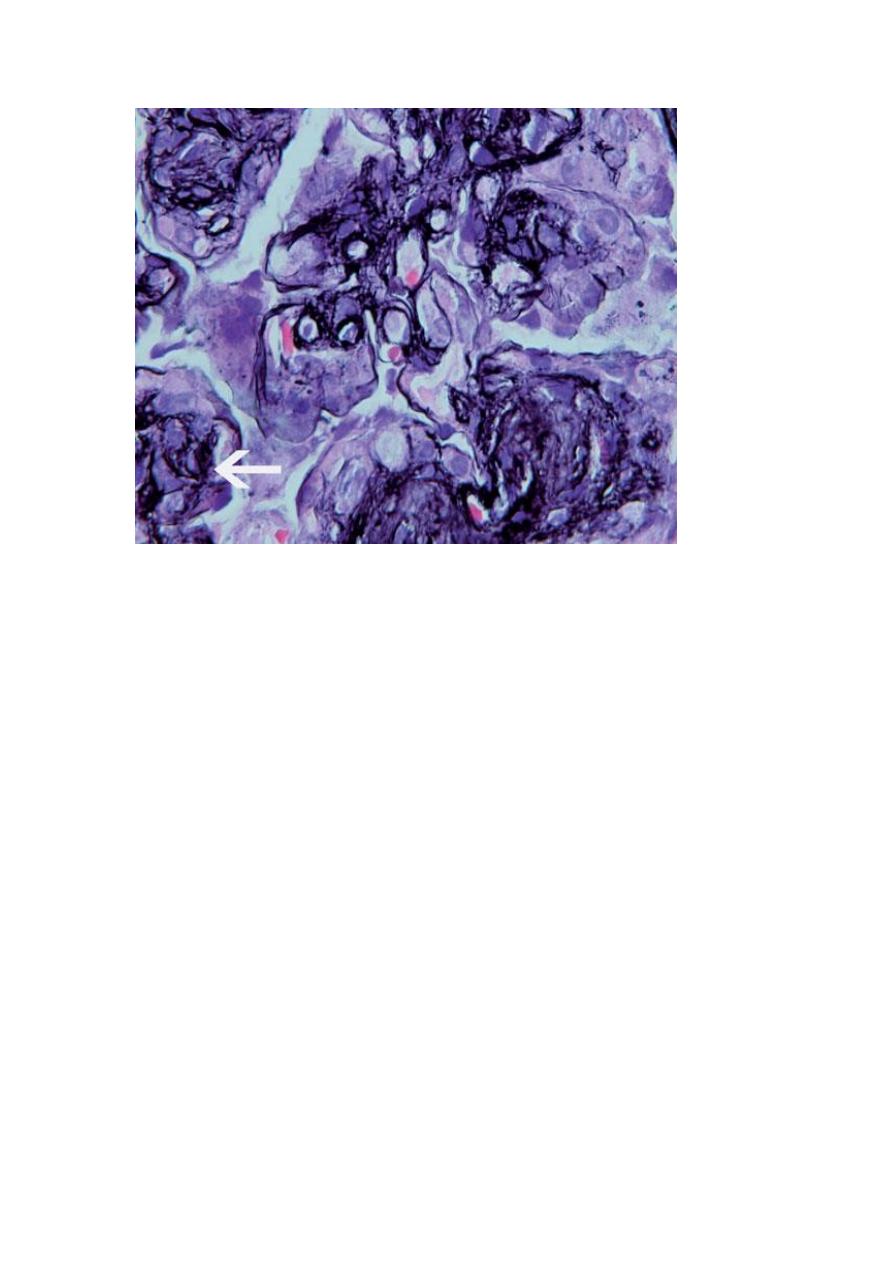
thickening of the basement membrane (“tram-track” appearance) at the arrow. Jones silver stain
,
THE NEPHRITIC SYNDROME
This is a clinical complex, usually of acute onset, characterized by
1. Hematuria
2. Oliguria with azotemia
3. Hypertension
The lesions that cause the nephritic syndrome have in common proliferation of the
cells within the glomeruli, accompanied by leukocytic infiltrate. This inflammatory
reaction injures the capillary walls, permitting escape of red cells into the urine, and
induces hemodynamic changes that lead to a reduction in the GFR. The reduced GFR
is manifested clinically by oliguria, fluid retention, and azotemia. Hypertension is the
result of both the fluid retention and excessive renin release. The acute nephritic
syndrome may be secondary to a systemic disorders such as SLE, or it may be the
result of primary glomerular disease e.g. acute postinfectious GN.
Acute postinfectious (Poststreptococcal) GN is typically associated with
streptococcal infection, but other infectious agents may be responsible. The latter
include certain pneumococcal and staphylococcal infections, as well as some common
viral diseases such as mumps, measles, chickenpox, and hepatitis B and C. The classic
case of poststreptococcal GN develops in a child 1 to 4 weeks after recovery from
"nephritogenic" strains of β-hemolytic, group A streptococcal infection, usually of the
pharynx or skin. Immune complex deposition is involved in the pathogenesis. The
relevant antigens are probably streptococcal proteins. Serum complement levels are
low and serum anti-streptolysin O antibody titers are elevated. Characteristically the
histology shows a uniformly increased cellularity of the glomerular tufts that affects
nearly all glomeruli. This increased cellularity is caused both by proliferation and
swelling of both endothelial and mesangial cells as well as by a neutrophilic and
monocytic infiltrate. Recovery occurs in most children. Conversely up to 50% of
adults develop end-stage renal disease.
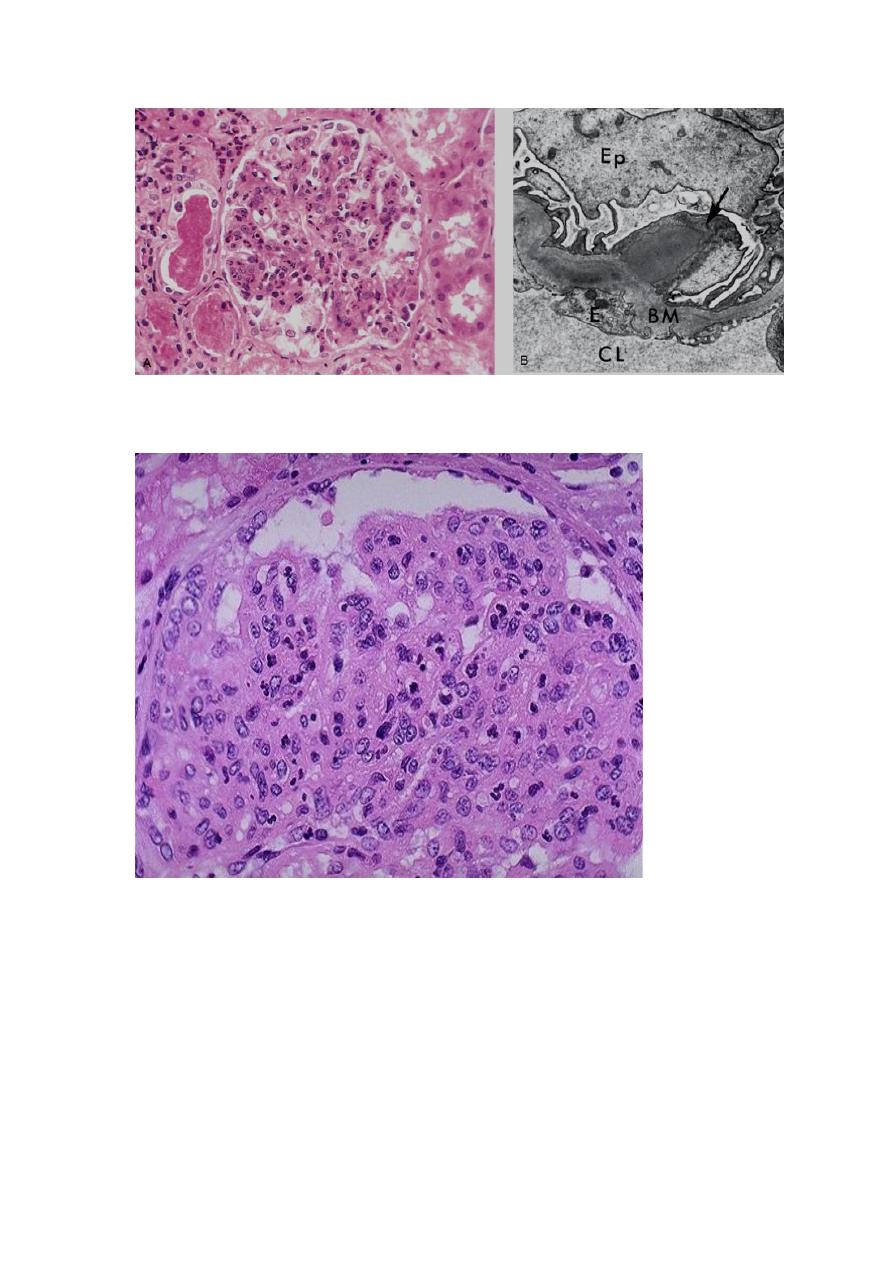
A, Glomerular hypercellularity is caused by intracapillary leukocytes and proliferation of intrinsic
glomerular cells. Note the red cell casts in the tubules. B, Typical electron-dense subepithelial "hump"
(arrow) and intramembranous deposits. BM, basement membrane; CL, capillary lumen; E, endothelial cell;
Ep, visceral epithelial cells (podocytes).
The hypercellularity of post-streptococcal glomerulonephritis is due to increased numbers of epithelial,
endothelial, and mesangial cells as well as neutrophils in and around the capillary loops. This disease may
follow several weeks after infection with certain strains of group A beta hemolytic streptococci. Patients
typically have an elevated anti-streptolysin O (ASO) titer.
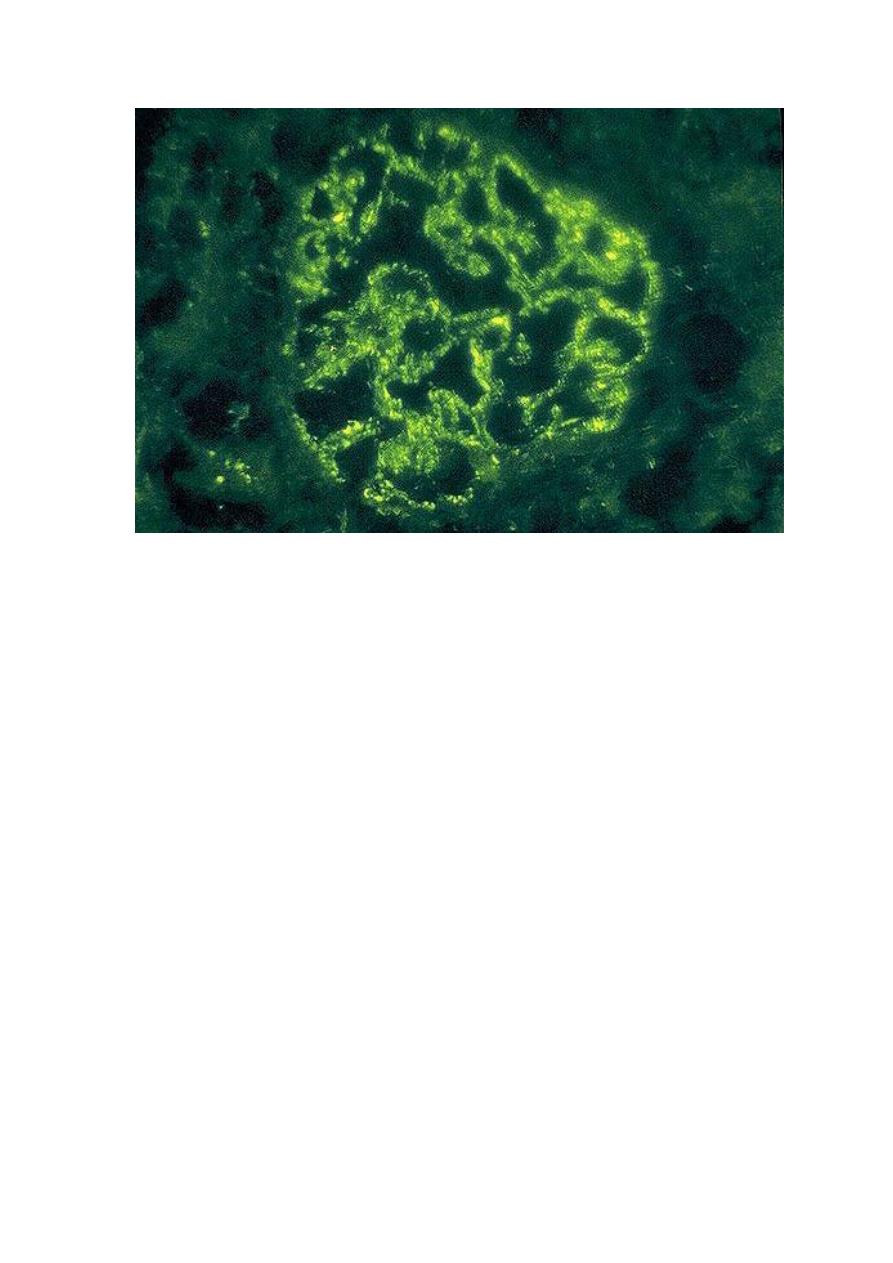
Post-streptococcal glomerulonephritis is immunologically mediated, and the immune deposits are distributed in the
capillary loops in a granular, bumpy pattern because of the focal nature of the deposition process.
IgA Nephropathy (Berger Disease) usually affects children and young adults as an
episode of gross hematuria occurring within 1 or 2 days of a nonspecific upper
respiratory tract infection (or less commonly gastrointestinal or urinary infection.), to
lasts several days and then subsides, only to recur every few months. IgA nephropathy
is one of the most common causes of recurrent microscopic or gross hematuria and is
the most common glomerular disease revealed by renal biopsies worldwide. The
pathogenic hallmark is the deposition of IgA in the mesangium. IgA nephropathy may
be viewed as a localized (renal) variant of Henoch-Schönlein purpura, which is also
characterized by IgA deposition in the mesangium but it is a systemic syndrome
characterized by purpuric rash, abdominal pain and arthritis. Microscopically, the
glomeruli may be normal or show one of the following:
1. Focal proliferative GN
2. Diffuse mesangioproliferative GN
3. Crescentic GN (rare).
Serum IgA is increased in 50% of patients due to its increased production in the
marrow presumably in response to respiratory or GIT exposure to viruses, bacteria, or
food proteins. Slow progression to chronic renal failure occurs in up to 50% of cases.
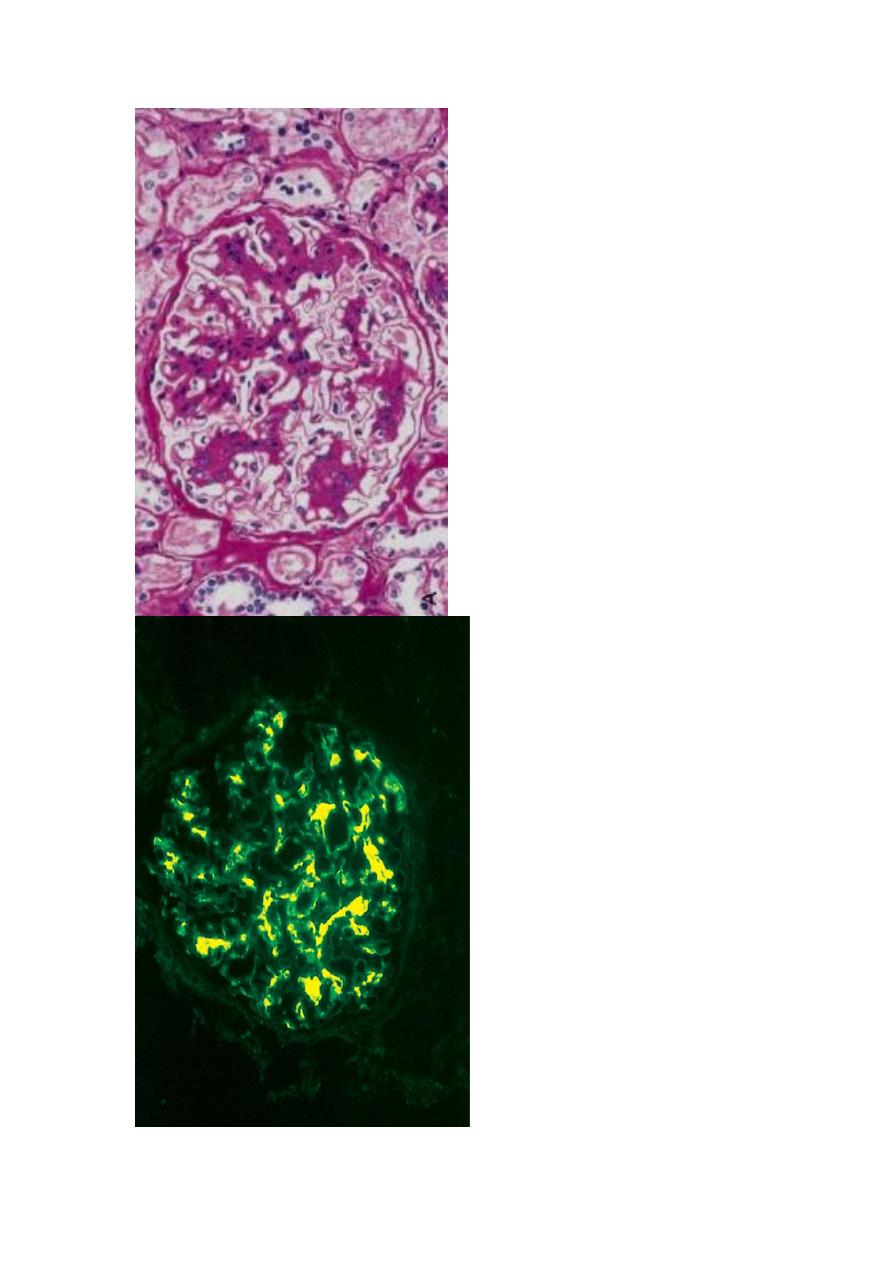
A, Light microscopy showing mesangial proliferation and matrix increase.

B. There is characteristic immunofluorescence deposition of IgA, principally in mesangial regions.
Rapidly Progressive (Crescentic) Glomerulonephritis (RPGN; CrGN)
This is a clinical syndrome associated, irrespective of the etiology, with glomerular
crescents; these are produced by proliferation of the parietal epithelial cells associated
with infiltration by monocytes and macrophages. CrGN is characterized clinically by
1. Rapidly progressive loss of renal function
2. Nephritic syndrome
3. Severe oliguria (often)
4. Death from renal failure within weeks to months (if untreated).
The onset of RPGN is much like that of the nephritic syndrom. Proteinuria sometimes
approaching nephrotic range may occur. The prognosis can be related to the number
of crescents; those with crescents in less than 80% of the glomeruli have a better
prognosis than those with higher percentages of crescents.
A practical classification divides CrGN into three groups on the basis of immunologic
findings. In each group, the disease may be associated with a known disorder or it
may be idiopathic.
1. Type I (Anti-GBM Antibody): Anti-GBM antibodies are present in the serum
and are helpful in diagnosis.
a. Idiopathic (renal without pulmonary involvement)
b. Goodpasture syndrome
This group is characterized by linear IgG deposits along the GBM. In some of these
individuals the anti-GBM antibodies also bind to pulmonary alveolar capillary
basement membranes to produce the clinical picture of pulmonary hemorrhages
associated with renal failure (Goodpasture syndrome).
2. Type II (Immune Complex):
a. Idiopathic
b. Postinfectious/infection related
c. SLE
d. Henoch-Schönlein purpura/IgA nephropathy
In all of these cases, immunofluorescence shows the characteristic granular pattern of
staining of the GBM and/or mesangium for immunoglobulin and/or complement. In
addition to the crescents, segments of glomeruli show evidence of the underlying GN.
3. Type III (Pauci-Immune) ANCA Associated
a. Idiopathic
b. Wegener granulomatosis
c. Microscopic angiitis
This group is defined by the lack morphologically of both anti-GBM antibodies and
immune complex deposition. Most of these individuals have antineutrophil
cytoplasmic antibodies (ANCA) in the serum. The latter have a role in some
vasculitides. Therefore, in some cases type there is a component of a systemic
vasculitis. In the idiopathic form the disease is limited to the kidney. The uninvolved
segments of glomeruli appear normal.
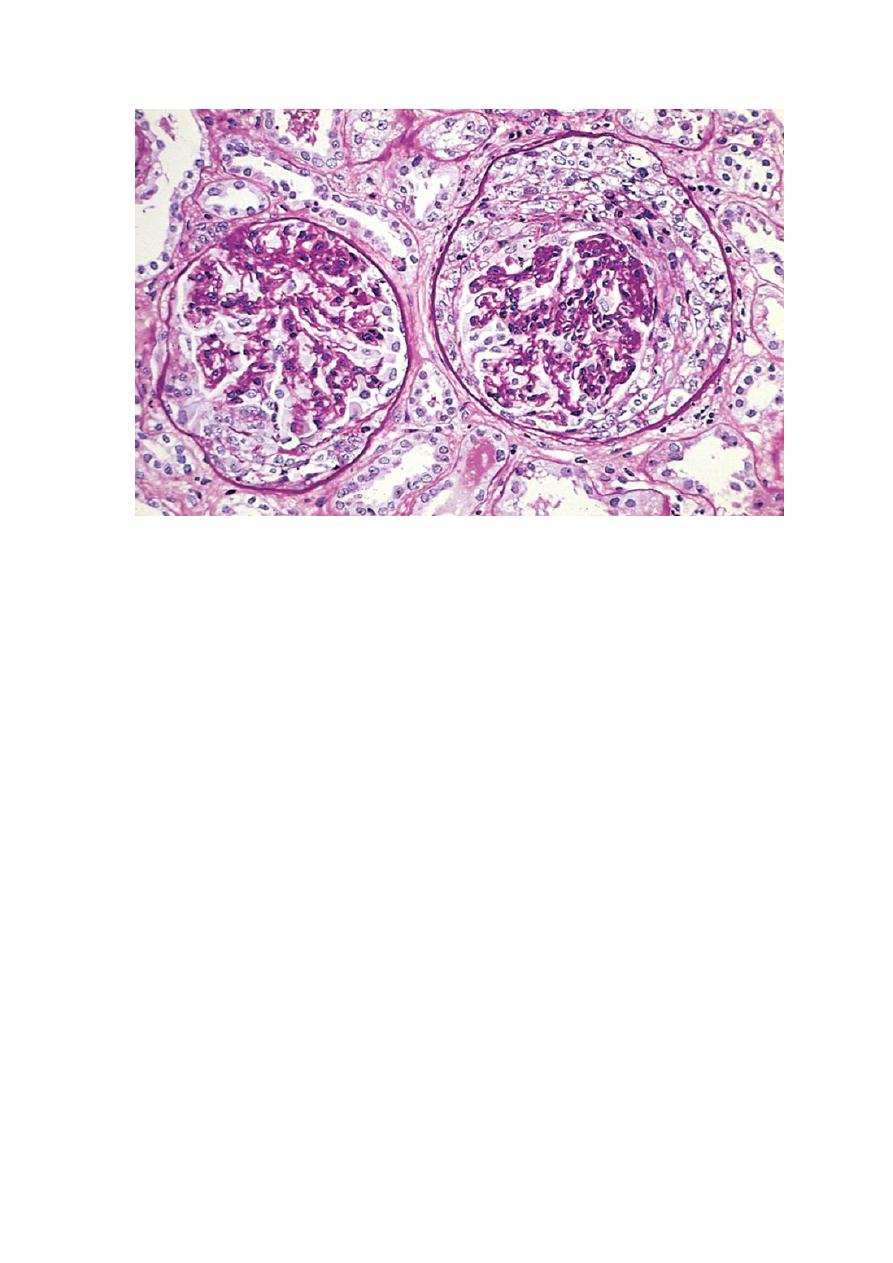
Note the collapsed glomerular tufts and the crescent-shaped mass of proliferating cells and leukocytes
internal to Bowman's capsule
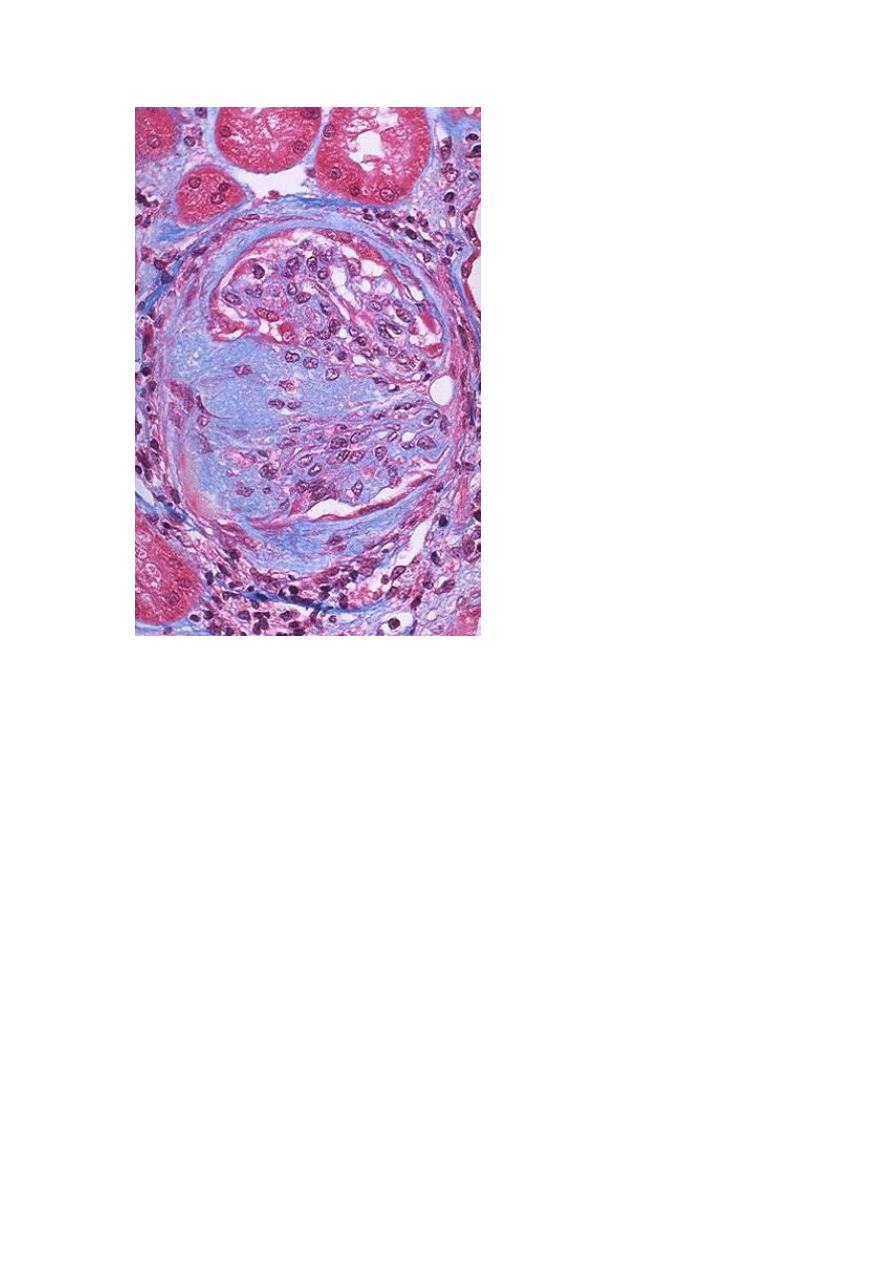
CHRONIC GLOMERULONEPHRITIS is one of the outcomes of the various
glomerular diseases already discussed. It is an important cause of end-stage renal
disease. Among all individuals who require chronic hemodialysis or renal
transplantation, 30% to 50% have the diagnosis of chronic GN. By the time chronic
GN is discovered, the glomerular changes are so advanced that it is difficult to detect
the nature of the original lesion. Classically, the kidneys are symmetrically contracted
with red-brown surface. Microscopically, the feature common to all cases is advanced
scarring of the glomeruli, sometimes to in the point of complete sclerosis. There is
relentless progression to uremia and death. The rate of progression is extremely
variable. Renal dialysis and kidney transplantation alter this course and allow long-
term survival.
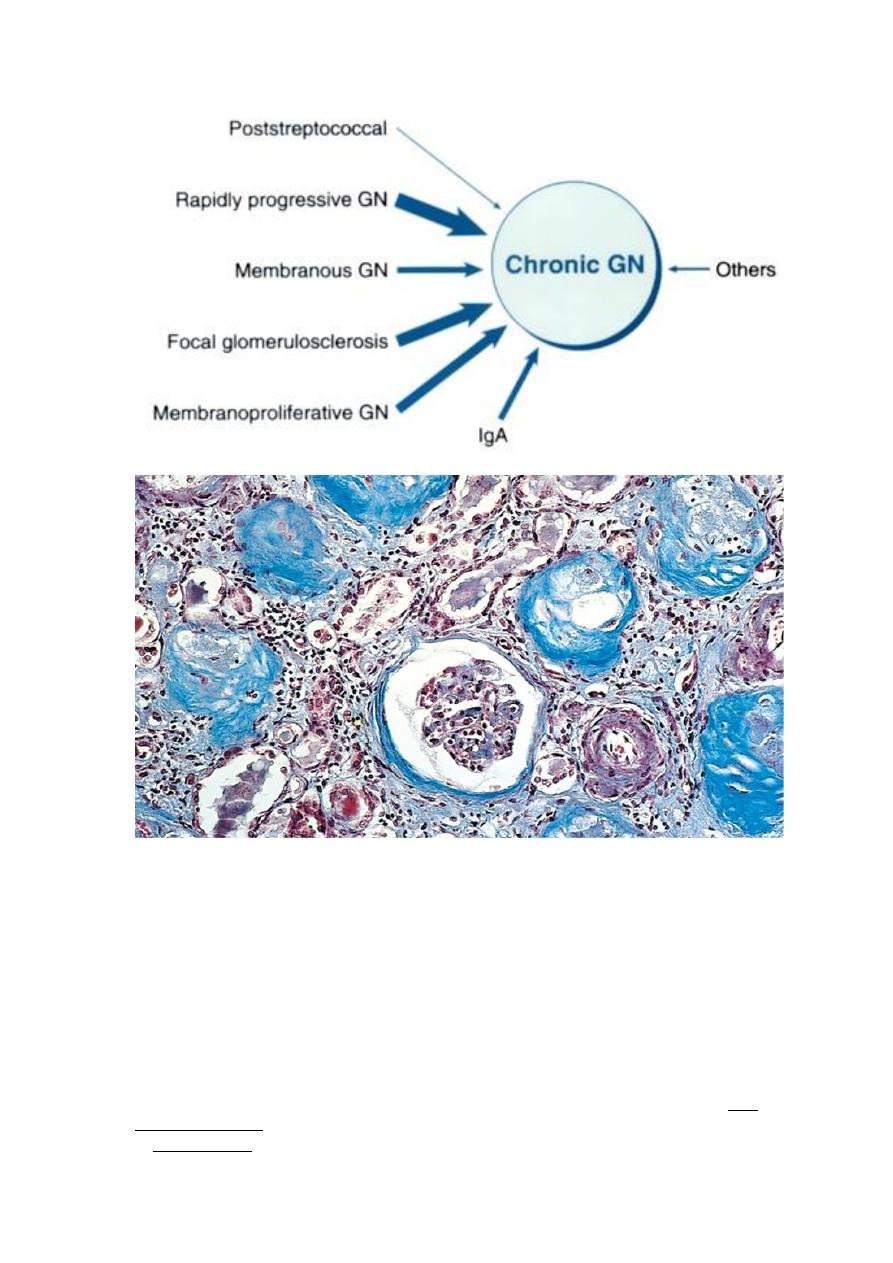
A Masson trichrome preparation shows complete replacement of virtually all glomeruli by blue-staining
collagen.
TUBULO-INTERSTITIAL DISEASES
Most forms of tubular injury also involve the interstitium, so the two are discussed
together. Under this heading are two categories
1. Inflammatory involvement of the tubules and interstitium (tubulo-interstitial
nephritis)
2. Ischemic or toxic tubular necrosis leading to acute renal failure
TUBULOINTERSTITIAL NEPHRITIS (TIN):
TIN is a group of inflammatory diseases of the kidneys primarily involving the
interstitium and tubules. The glomeruli are spared or affected late in the course. TIN
is subdivided into
1. Bacterial TIN, the renal pelvis is prominently involved (pyelonephritis)

2. Nonbacterial TIN ; these include tubular injury resulting from
a. drugs
b. metabolic disorders (e.g. hypokalemia)
c. physical injury (e.g. irradiation)
d. viral infections
e. immune reactions
Pyelonephritis
This is divided into acute and chronic forms
Acute pyelonephritis is a common bacterial suppurative inflammation of the kidney
(nephritis) and renal pelvis (pyelitis); hence the term pyelonephritis. The great
majority of cases of pyelonephritis are associated with lower UTI (cystitis, prostatitis,
and urethritis). E. coli is by far the most common offender. Other important organisms
are Proteus, Klebsiella, Enterobacter, and Pseudomonas; these are usually associated
with recurrent infections, especially due to urinary tract instrumentations (e.g.
cystoscopy, catheterization) or congenital or acquired anomalies of the lower urinary
tract (e.g. vesicoureteral reflux or polycystic kidney disease, presence of stones,
prostatic hyperplasia in the elderly).
Pathogenesis
Bacteria can reach the kidneys either through the bloodstream (hematogenous) or
from the lower urinary tract (ascending infection). The former is exemplified by acute
pyelonephritis complicating septicemia or infective endocarditis. Ascending infection
from the lower urinary tract is the most common & is an important route by which
bacteria reach the kidney. The evolution of acute pyelonephritis occurs through the
following steps
1. Bacterial adhesion to the urethral urothelium is influenced by genetically
determined properties of both the urothelium and the offending bacteria.
2. Gaining access to the bladder is by growth expansion of the colonies and by
moving against urine flow assisted by urethral instrumentation, including
catheterization and cystoscopy. In the absence of instrumentation, UTI most
commonly affects females because of factors that facilitate entry of bacteria to the
bladder; these are
a. Close proximity of the urethra to the enteric bacteria-loaded rectum
favoring colonization
b. Short urethra
c. Trauma to the urethra during sexual intercourse (honeymoon cystitis)
3. Outflow obstruction: normally, bladder urine is sterile as a result of the
antimicrobial properties of the bladder mucosa and the flushing action of periodic
voiding of urine. With outflow obstruction or bladder dysfunction, these natural
defenses are overwhelmed, setting the stage for UTI. Obstruction at the level of the
urinary bladder (e.g. by prostatic hyperplasia) results in incomplete bladder emptying
and hence increased residual volume of urine (urine stasis). In the presence of stasis,
bacteria introduced into the bladder can multiply freely, without being flushed out or
destroyed by the bladder mucosa. From the contaminated bladder urine, the bacteria
ascend along the ureters to infect the renal pelvis and parenchyma. Thus, UTI is
particularly frequent in association with benign prostatic hyperplasia in male and
uterine prolapse in females. UTI is also frequent in diabetics because of the increased
susceptibility to infection and neurogenic bladder, which in turn predisposes to urine
stasis.

4. Vesicoureteral reflux (VUR): incompetence of the vesicoureteral orifice allows
bacterial ascent along the ureter & then into the pelvis. The normal ureteral insertion
into the bladder is a competent one-way valve that prevents retrograde flow of urine,
especially during micturition, when the intra-vesical pressure rises. An incompetent
vesicoureteral orifice allows the reflux of bladder urine into the ureters; this is termed
vesicoureteral reflux (VUR). Up to 40% of young children with UTI have this
anomaly, which is usually a congenital defect. VUR can also be acquired in
individuals with a flaccid bladder resulting from spinal cord injury and with
neurogenic bladder dysfunction secondary to diabetes. The effect of VUR is similar to
that of an obstruction in that after voiding there is residual urine in the urinary tract,
which favors bacterial growth. Furthermore, VUR affords a ready mechanism by
which the infected bladder urine can be pushed up to the renal pelvis and further into
the renal parenchyma through open ducts at the tips of the papillae (intrarenal reflux).
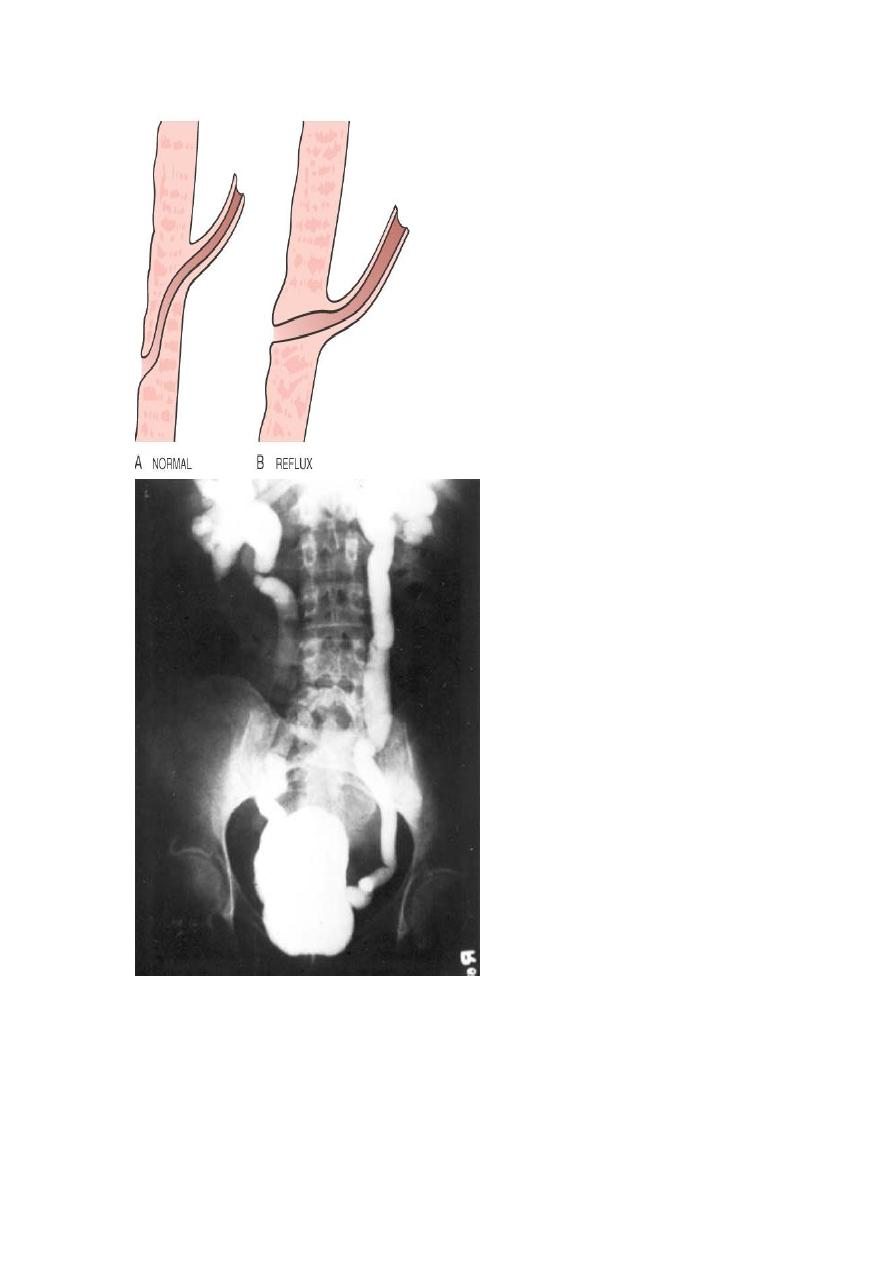
The vesicoureteral junction. In normal individuals (A), the intravesical portion of the ureter is oblique, such
that the ureter is closed by muscle contraction during micturition. The most common cause of reflux is
congenital complete or partial absence of the intravesical ureter (B).
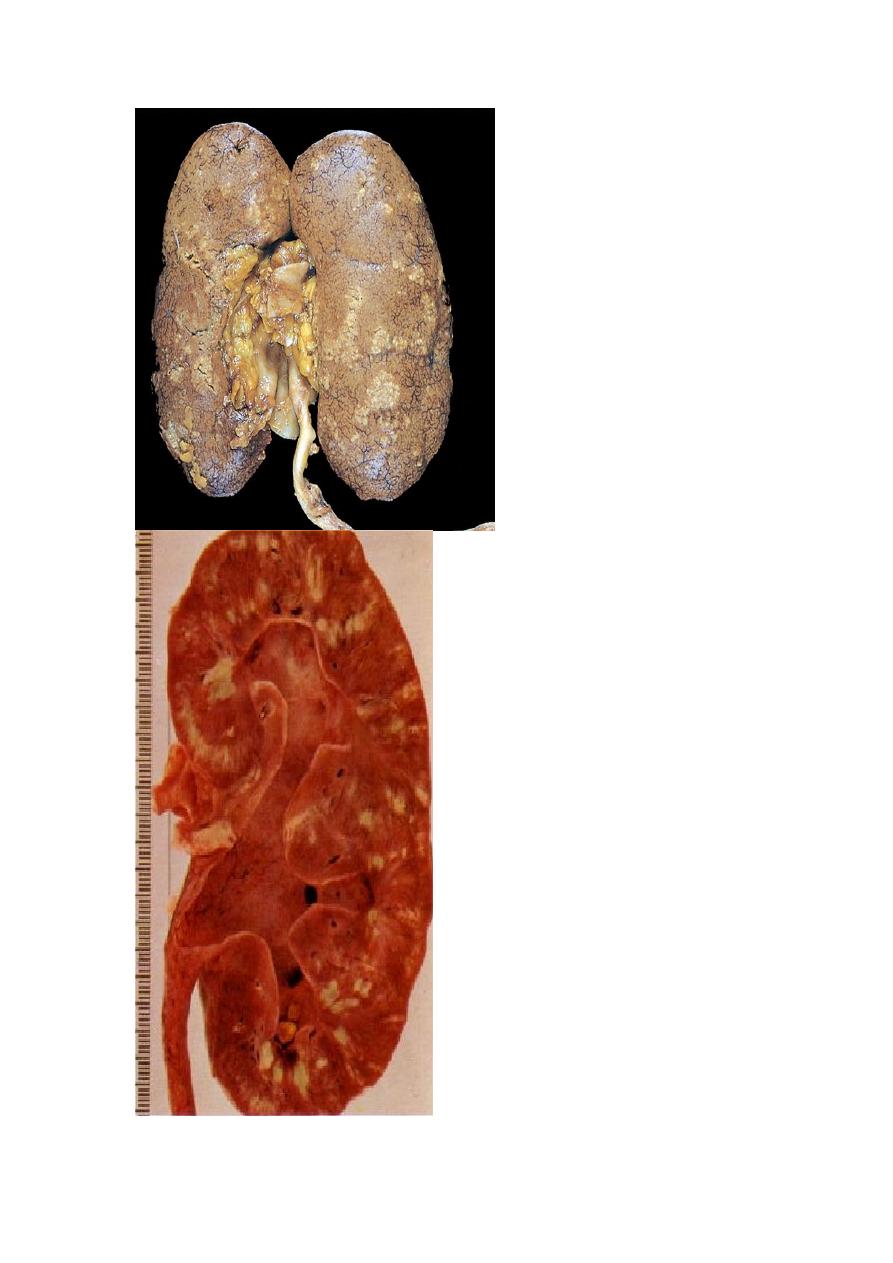
Gross features of acute pyelonephritis
One or both kidneys may be involved. The affected kidney may be normal in size or
enlarged.

Characteristically, discrete, yellowish, raised abscesses are grossly apparent on the
renal surface. They are variably scattered and may coalesce to form a single large
abscess.
When obstruction is prominent, the pus may fill the renal pelvis, calyces, and ureter,
producing pyonephrosis.
Microscopic features
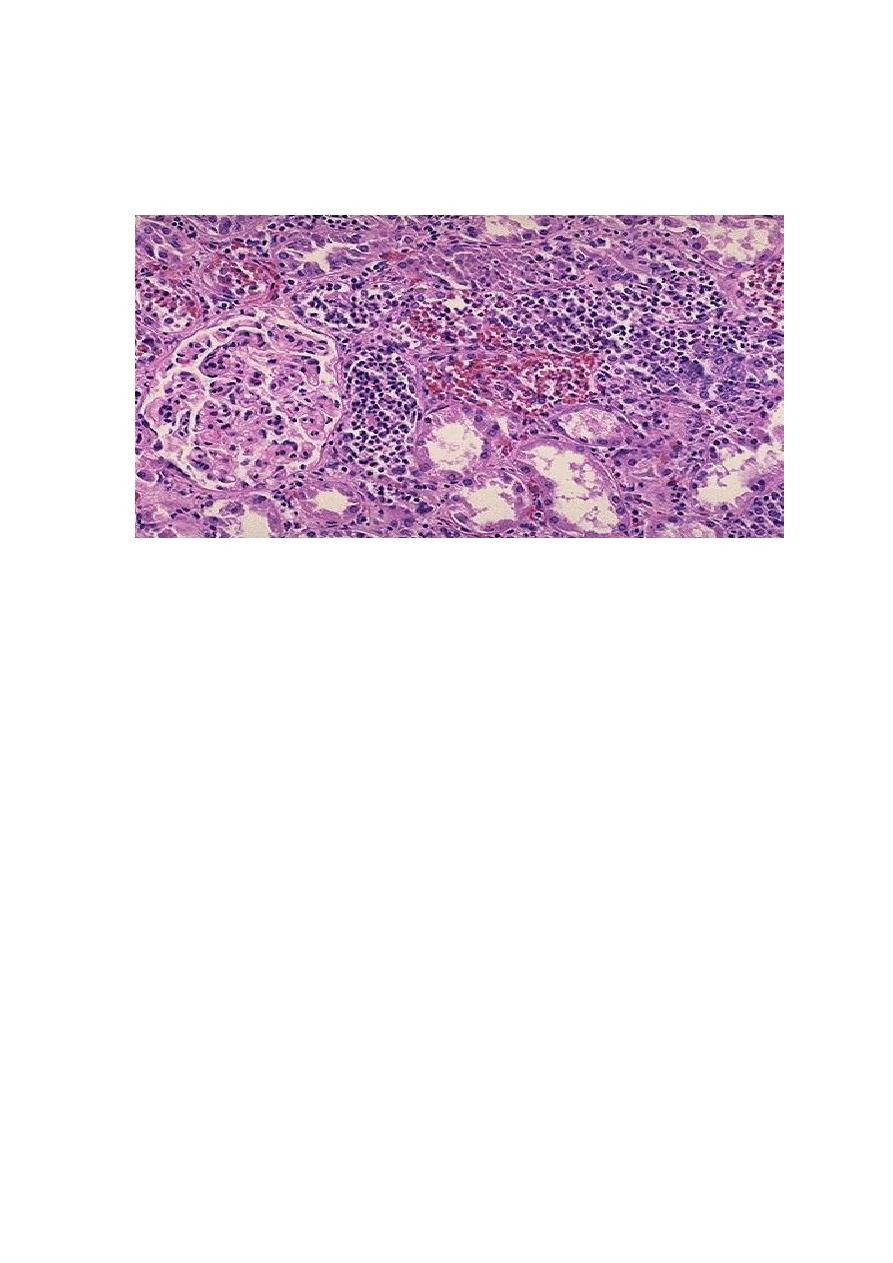
The characteristic feature of acute pyelonephritis is suppurative inflammation within
the renal parenchyma. Both the tubules & interstitium are involved.
Large numbers of intratubular neutrophils frequently extend into the collecting
ducts, giving rise to the characteristic white cell casts found in the urine.
Typically, the glomeruli are not affected.
There is intense acute neutrophilic infiltration within tubules and the renal substance.
Chronic Pyelonephritis (CPN) and Reflux Nephropathy
For the pathological diagnosis of CPN two criteria must be met
1. Grossly visible scarring deformity of the pelvicalyceal system
2. Microscopic predominance of interstitial inflammation & fibrosis
CPN is an important cause of chronic renal failure. It can be divided into two forms:
1. Chronic obstructive pyelonephritis: recurrent infections superimposed on
obstructive lesions lead to recurrent bouts of renal inflammation and scarring, which
eventually cause chronic pyelonephritis. The disease can be bilateral, as with
congenital anomalies of the urethra (posterior urethral valves), or unilateral, such as
occurs with calculi and unilateral obstructive lesions of the ureter.
2. Chronic reflux-associated pyelonephritis is the more common form and results
from superimposition of a UTI on congenital vesicoureteral reflux and intrarenal
reflux. Reflux may be unilateral or bilateral; thus, the resultant renal damage is either
unilateral or bilateral.
Gross features:
One or both kidneys may be involved, either diffusely or in patches. Even when
involvement is bilateral, the kidneys are not equally damaged and therefore are not
equally contracted. This uneven involvement is useful in differentiating CPN from the
more symmetrically contracted kidneys of benign nephrosclerosis and chronic GN.
The hallmark of CPN is scarring involving the pelvis &/or calyces leading to
marked calyceal deformities
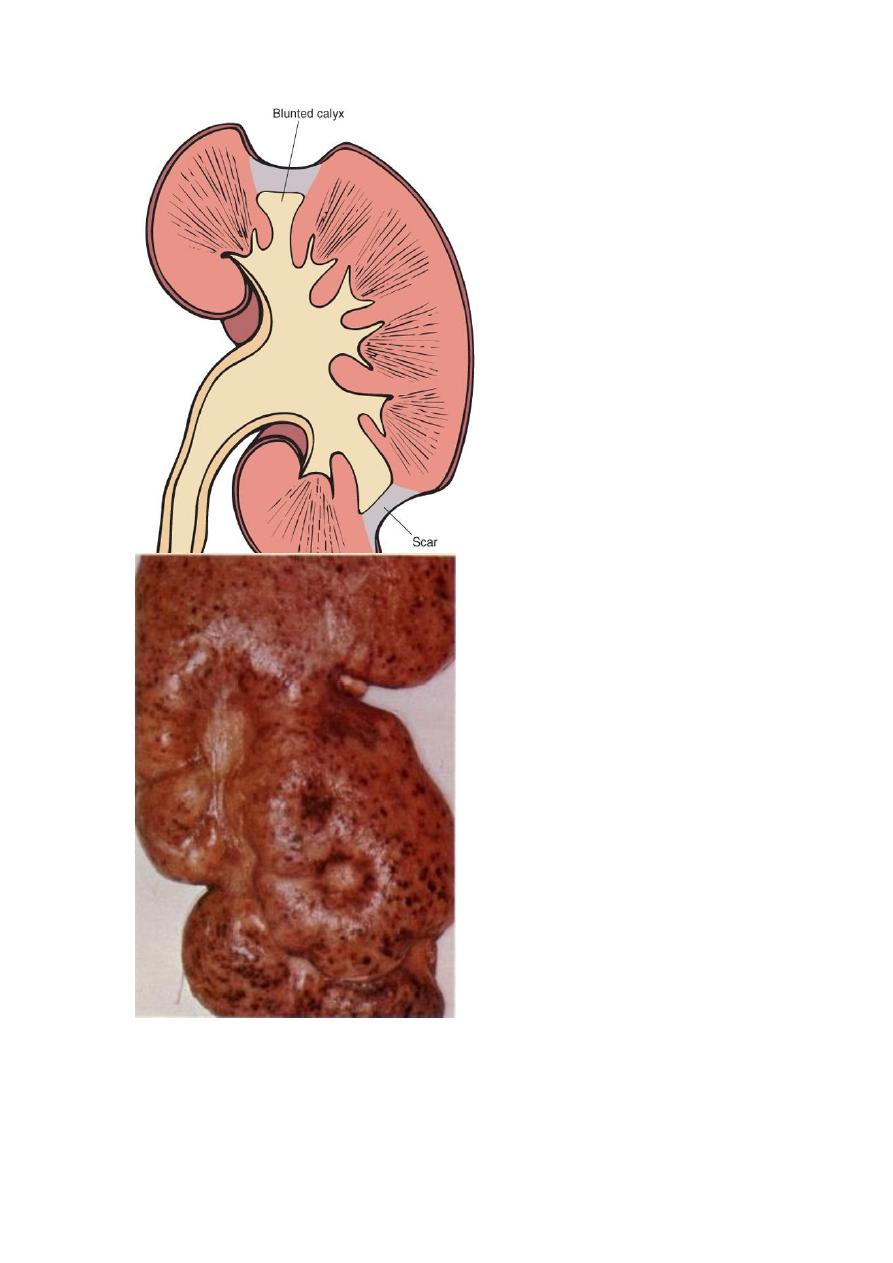
Typical coarse scars of chronic pyelonephritis associated with vesicoureteral reflux. The scars are usually
located at the upper or lower poles of the kidney and are associated with underlying blunted calyces.
Microscopic features:
These are largely non-diagnostic since similar alterations may be seen with other
tubulo-interstitial disorders such as analgesic nephropathy.
The parenchyma shows the following features:
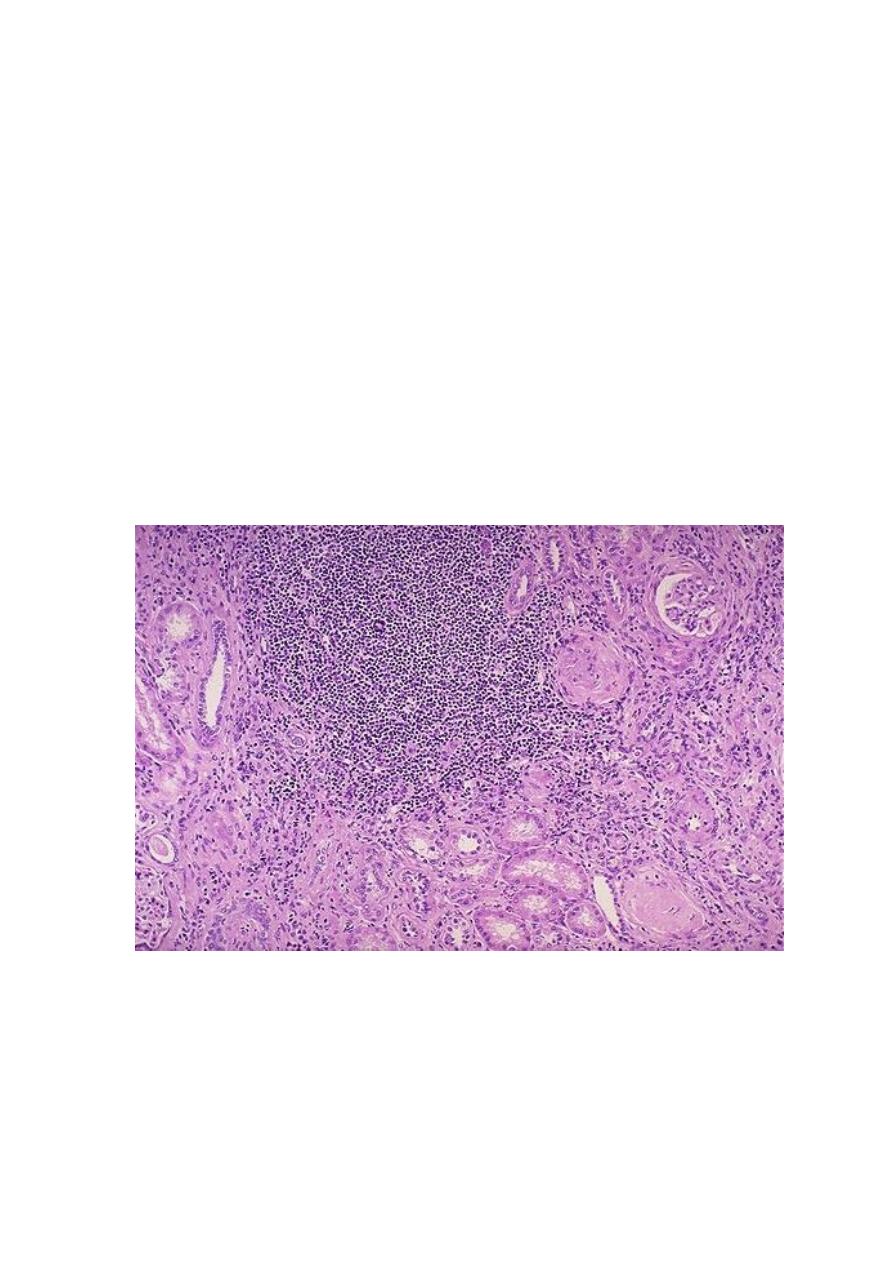
- Interstitial fibrosis with infiltration by lymphocytes, plasma cells, and sometimes
neutrophils
- Dilation or contraction of tubules, with atrophic lining epithelium. Many of the
dilated tubules contain pink to blue colloid-like casts; the overall appearance is
reminiscent of thyroid tissue, hence the descriptive term thyroidization.
Chronic inflammation with fibrosis involving the pelvi-calyceal mucosa and wall.
This
is an important feature that is used in the differentiation from other conditions that
give otherwise similar parenchymal changes.
Vascular changes of benign arteriolosclerosis caused by the frequently associated
hypertension.
Although glomeruli may be normal, some are sclerosed (glomerulosclerosis). Such
changes represent maladaptive changes secondary to nephron loss.
Absence of significant bacteriuria should not rule out CPN. If the disease is bilateral
and progressive, tubular dysfunction occurs with loss of concentrating ability,
manifested by polyuria and nocturia. Some persons with CPN or reflux nephropathy
ultimately develop glomerular lesions of global sclerosis and secondary FSGS. These
are associated with proteinuria and eventually contribute to progressive chronic renal
failure.
There is a large collection of chronic inflammatory cells associated with fibrosis that involves the interstitum
& periglomerular areas (arrow). This biopsy is from here a patient with a history of multiple recurrent
urinary tract infections.
Drug-Induced Interstitial Nephritis (DIN)
Drugs are important causes of renal injury. There are two forms of DITN:
1. Acute DIN: this is most frequently occurs with such drugs as methicillin,
ampicillin, rifampin, thiazide diuretics, NSAID, phenindione, and cimetidine. Most
likely, the drugs act as haptens that bind to a cytoplasmic or extracellular component

of the secreting tubular cells and become immunogenic. It is important to recognize
drug-induced renal damage, because withdrawal of the offending drug is followed by
recovery.
2. Analgesic Nephropathy: with the intake of large quantities of analgesics, patients
may develop chronic interstitial nephritis. Most people who develop this nephropathy
consume mixtures containing some combination of aspirin, paracetamol, caffeine, and
codeine for long periods. Papillary necrosis is the initial event, and the interstitial
nephritis in the overlying renal parenchyma is a secondary phenomenon. Cessation of
analgesic intake may stabilize or even improve renal function.
Acute Tubular Necrosis (ATN)
This is a clinicopathologic entity characterized acute renal failure due to necrosis of
tubular epithelial cells. It is the most common cause of acute renal failure. ATN is a
reversible renal lesion that arises in clinical settings that have in common a period of
inadequate blood flow to the peripheral organs, often in the setting of marked
hypotension and shock. The pattern of ATN associated with shock is called ischemic
ATN. Hemolytic crises including mismatched blood transfusions, and myoglobinuria,
also produce a picture resembling ischemic ATN.
A second pattern, called nephrotoxic ATN, is caused by a variety of poisons,
including heavy metals (e.g., mercury); organic solvents (e.g., carbon tetrachloride);
and drugs such as gentamicin and other antibiotics, and radiographic contrast agents.
Pathogenesis
The decisive events in both ischemic and nephrotoxic ATN are believed to be
1. Tubular injury and
2. Severe disturbances in blood flow to tubular cells.
Tubular epithelial cells are sensitive to both anoxia & toxins.
Toxic injury eventuates in decreased Na
+
reabsorption by proximal tubules and
hence increased sodium delivery to distal tubules. The latter, through a tubulo-
glomerular feedback system, contributes to vasoconstriction and thus ischemia.
The debris resulting from shedding of tubular cells results can block urine outflow,
and eventually increases intratubular pressure, thereby decreasing GFR.
Additionally, fluid from the damaged tubules could leak into the interstitium,
resulting in increased interstitial pressure and collapse of the tubules.
Ischemic tubular cells also express chemokines, cytokines, and adhesion molecules
that recruit and immobilize leukocytes that can participate in tissue injury.
Ischemic renal injury is also characterized by severe hemodynamic alterations that
cause reduced GFR. The major one is intrarenal vasoconstriction, which results in
both reduced glomerular plasma flow and reduced oxygen delivery to the functionally
important tubules in the outer medulla.
Vasoconstriction is mediated by sublethal endothelial injury, leading to increased
release of the endothelial vasoconstrictor endothelin and decreased production of
vasodilatory nitric oxide and prostaglandins.
Pathological features
is characterized by
Necrosis of short segments mostly of the proximal tubule; thus necrosis may be
missed in biopsy samples.
Frequently a variety of tubular injuries are noted in the epithelial cells of proximal
convoluted tubules such as vacuolization and detachment of tubular cells into the
urine.
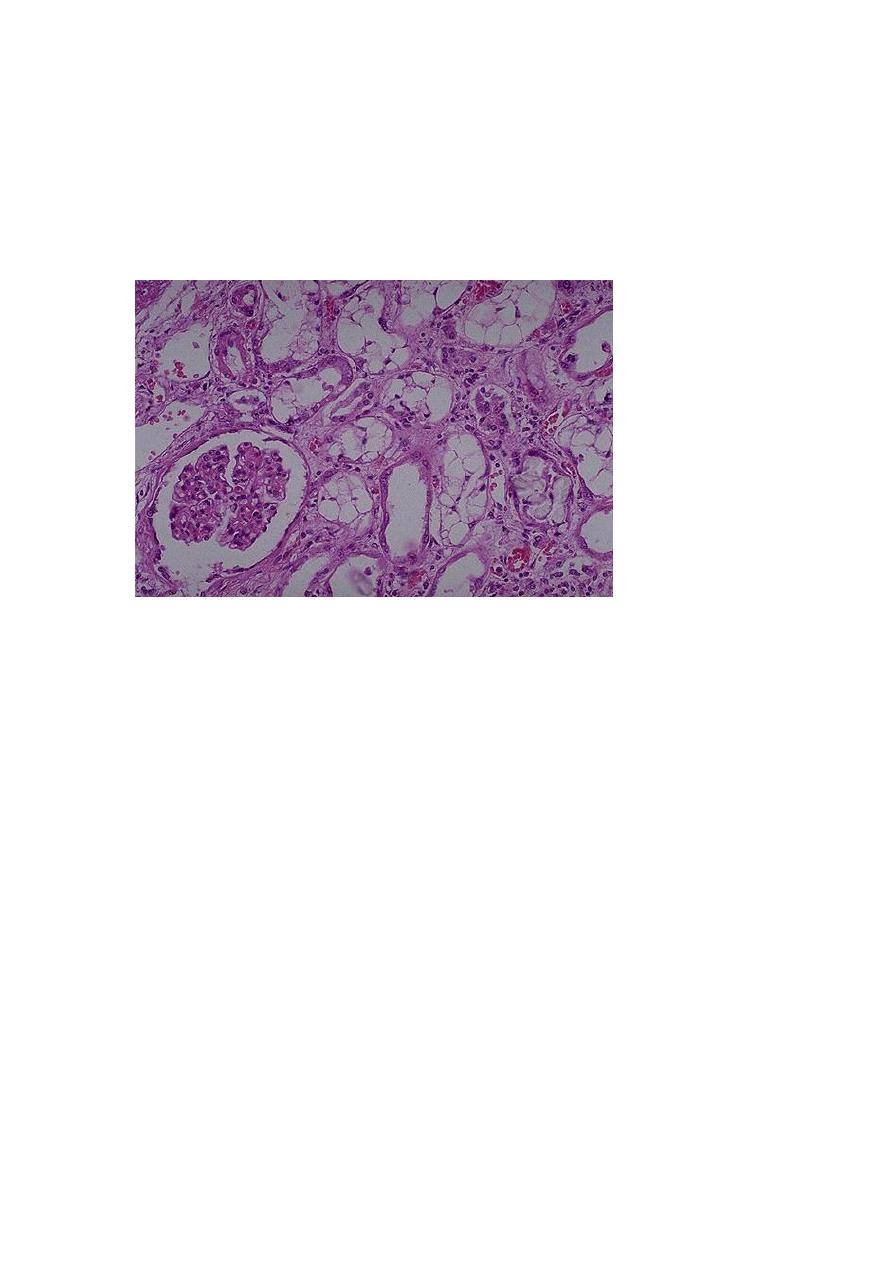
Presence of proteinaceous casts in the distal tubules and collecting ducts along with
hemoglobin and other plasma proteins.
When crush injuries have produced ATN, the casts are composed of myoglobin.
The interstitium usually shows generalized edema along with a mild inflammatory
infiltrate consisting of polymorphonuclear leukocytes, lymphocytes, and plasma cells.
In the toxic form Necrosis is more diffuse.
Except where the basement membrane is destroyed, regeneration is total and
complete.
There is prominent vacuolization of tubular epithelial cells. Some tubules show epithelial sloughing &
regeneration (arrow).
DISEASES OF RENAL BLOOD VESSELS
Changes affecting renal blood vessels are both frequent & important for the following
reasons
1. The renal vasculature is secondarily involved in almost all diseases of the kidney.
2. Various forms of systemic arteritis also involve renal vessels & such involvement is
clinically important.
3. The kidney is intimately involved in the pathogenesis of both essential and
secondary hypertension.
Benign Nephrosclerosis (BNS)
Some degree of BNS is present in many of those older than 60 years of age. The
frequency and severity of the lesions are increased at any age when hypertension or
diabetes mellitus are present. It is not clear whether BNS is the cause of hypertension
or conversely, hypertension just accelerates an age-related vascular sclerosis.
Malignant Nephrosclerosis
Malignant hypertension occurs in only about 5% of hypertensive patients. It may
occur de novo, or suddenly complicates mild hypertension.
Pathogenesis
The following sequence of events is suggested.
1. Initially, there is renal arteriolar vascular damage, mostly from long-standing
benign hypertension. The result is increased permeability of the small vessels to
fibrinogen and other plasma proteins, endothelial cell injury, and platelet deposition.
2. This leads to occurrence of fibrinoid necrosis of arterioles and small arteries with
thrombosis.

3. Platelet-derived and other growth factors cause intimal smooth muscle hyperplasia
that results in hyperplastic arteriolosclerosis (typical of malignant hypertension)
associated with further narrowing of the vascular lumina. The kidneys become
markedly ischemic.
4. With severe involvement of the renal afferent arterioles, the renin-angiotensin
system is stimulated. A self-perpetuating cycle is thus created in which angiotensin II
causes intrarenal vasoconstriction, and the resultant renal ischemia stimulates renin
secretion.
5. Aldosterone levels are elevated; the salt retention contributes to the elevation of
blood pressure.
The consequences of the markedly elevated blood pressure on the blood vessels
throughout the body are known as malignant arteriolosclerosis, and the renal disorder
is referred to as malignant nephrosclerosis.
