
Amino Acids
Objectives: 1. definition
2. Basic structure, Types
3. Essential & Nonessential amino acids
4. Nitogen Balance
5. Basic structure of protein & Types.
Amino Acids
Amino Acids are the building units of proteins.
Proteins are polymers of amino acids linked together by
what is called
“ Peptide bond”
There are about 300 amino acids occur in nature. Only
20 of them enter in proteins synthesis.
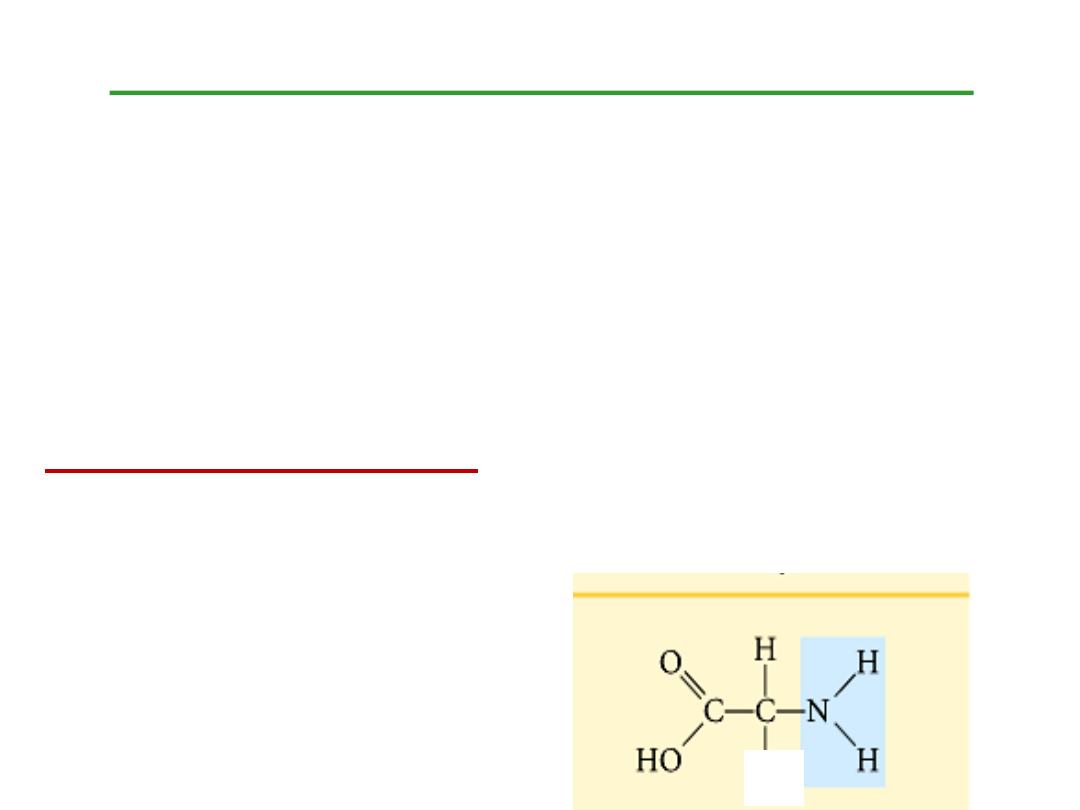
Structure of amino acids:
Each amino acid has 4 different groups attached to
α-
carbon ( which is C-atom next to COOH). These 4 groups
are : amino group, COOH gp,
Hydrogen atom and side
Chain (R)
R
•
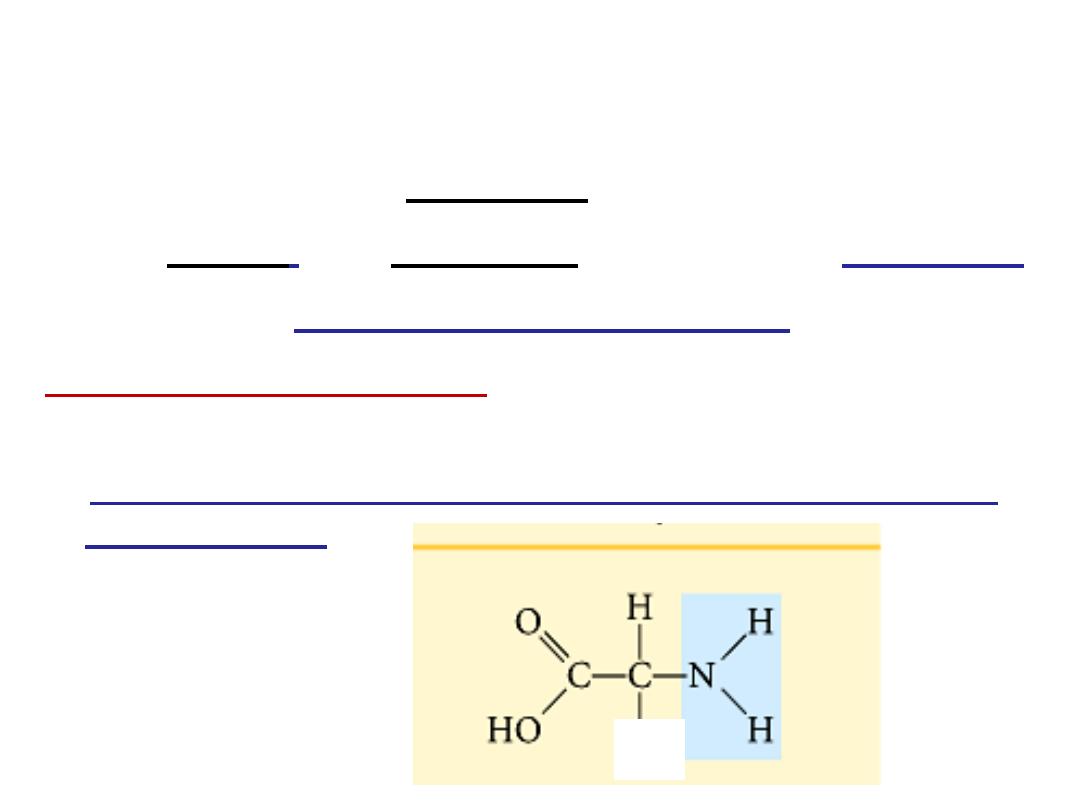
At physiological PH (7.4), -COOH gp is dissociated
forming a negatively charged carboxylate ion
(COO
-
)
and amino gp is protonated forming positively charged
ion
(NH
3
+
)
forming
Zwitter ion
•
N.B.
Proline
is an
imino acid
not amino acid (see latter)
Classification of amino acids
I- Chemical classification:
According to number of COOH
and NH
2
groups i.e. according to net charge on amino acid.
A- Monobasic& monocarboxylic amino acids i.e. neutral
or uncharged:
R
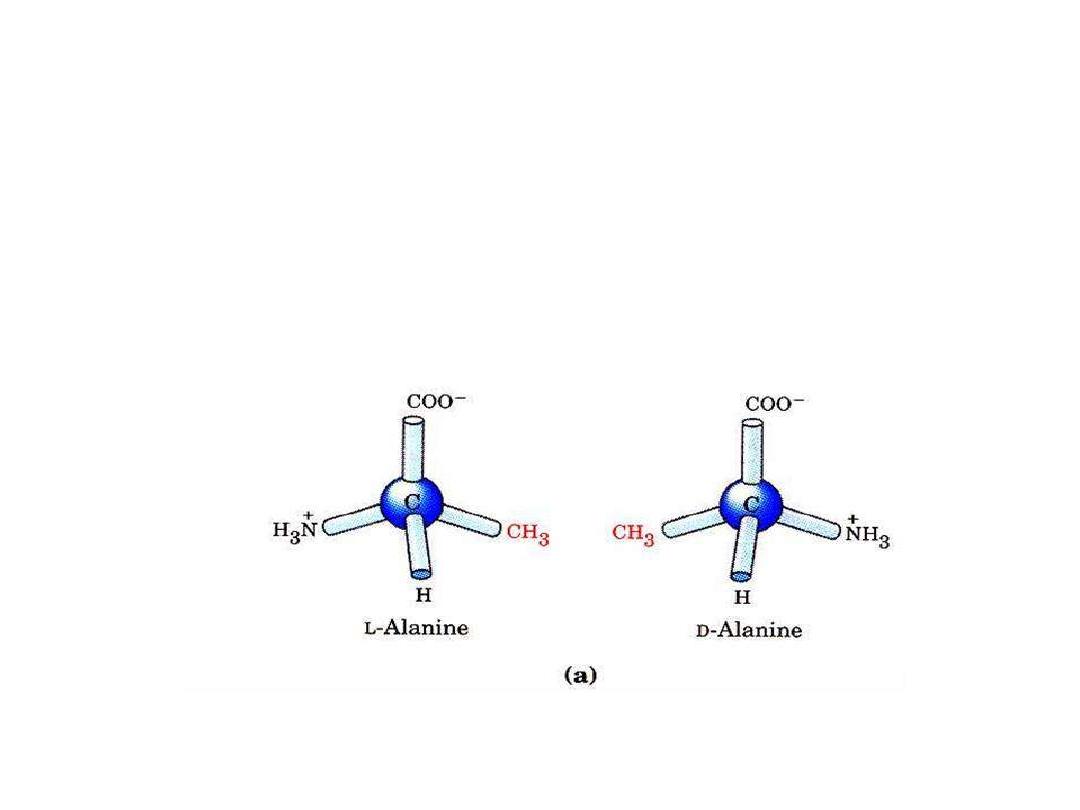
Only L-α amino acid occur in
proteins

Subclassification of neutral amino acids:
1- Glycine
R= H
2- Alanine
R= CH
3
3- Branched chain amino acids:
R is branched such as in:
a - Valine
R= isopropyl gp
b- Leucine
R= isobutyl gp
c- Isoleucine R = is isobutyl
4- Neutral Sulfur containing amino acids:
e.g. Cysteine and Methionine. Cystine,not involved in
proteins. It is dimer of cysteine linked by S-S bond(oxidized
form)
5- Neutral, hydroxy amino acids:
e.g. Serine and Threonine

6- Neutral aromatic amino acids:
a- Phenyl alanine
b- Tyrosine
: - it is P- hydroxy phenyl alanine
c- Tryptophan:
7- Neutral heterocyclic amino acids:
a- Tryptophan: contains indole ring
b- Proline:
In proline, amino group enters in the ring formation
being α-imino gp so proline is an α-imino acid
rather than α-amino acid
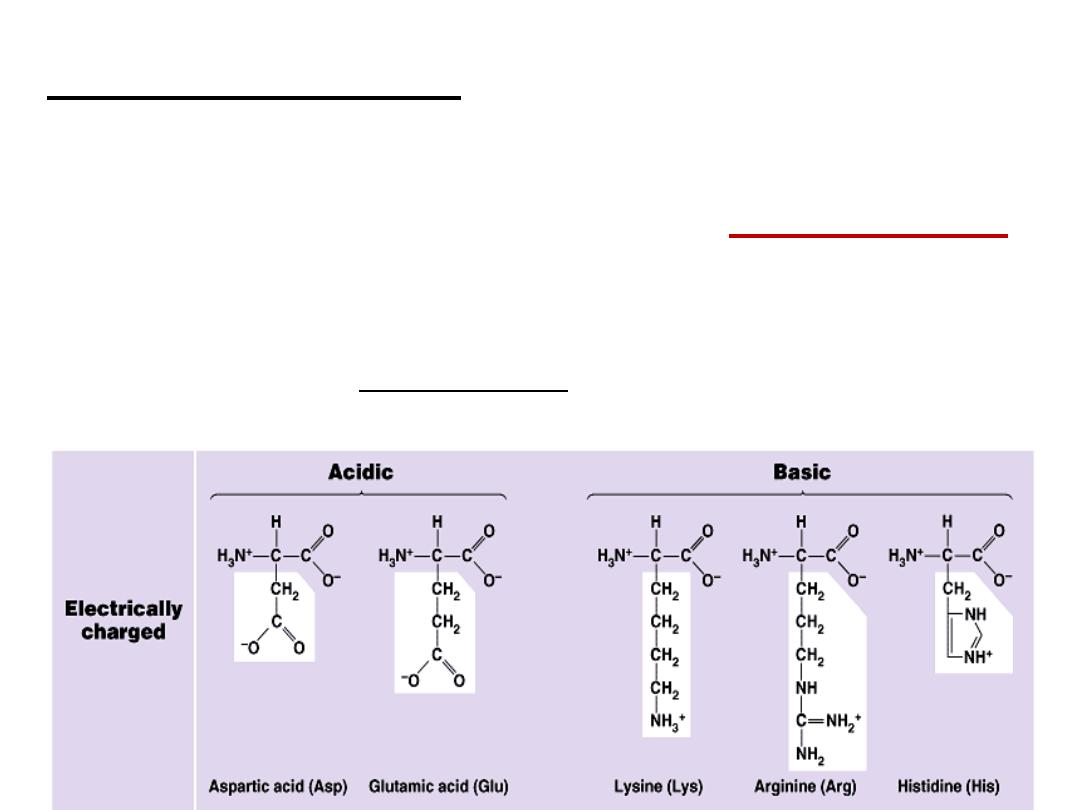
B- Basic amino acids: Contain two or more NH
2
groups or
nitrogen atoms that act as base i.e. can
bind proton.
At physiological pH, basic amino acids will be
positively charged
.
e.g.
a- Lysine
b- Arginine: contains guanido group
c- Histidine:

C
-
Acidic Amino acids:
at physiological pH will carry negative
charge.
e.g. Aspartic acid (aspartate) and Glutamic acid (glutamate). see
structures in hand out.
Aspargine and Glutamine:
They are amide forms of aspartate
and glutamate in which side chain COOH groups are amidated.
They are classified as neutral amino acids.

II- Classification according to polarity of side chain (R):
A- Polar amino acids:
in which R contains polar hydrophilic
group so can forms hydrogen bond with H
2
O. In those amino
acids, R may contain:
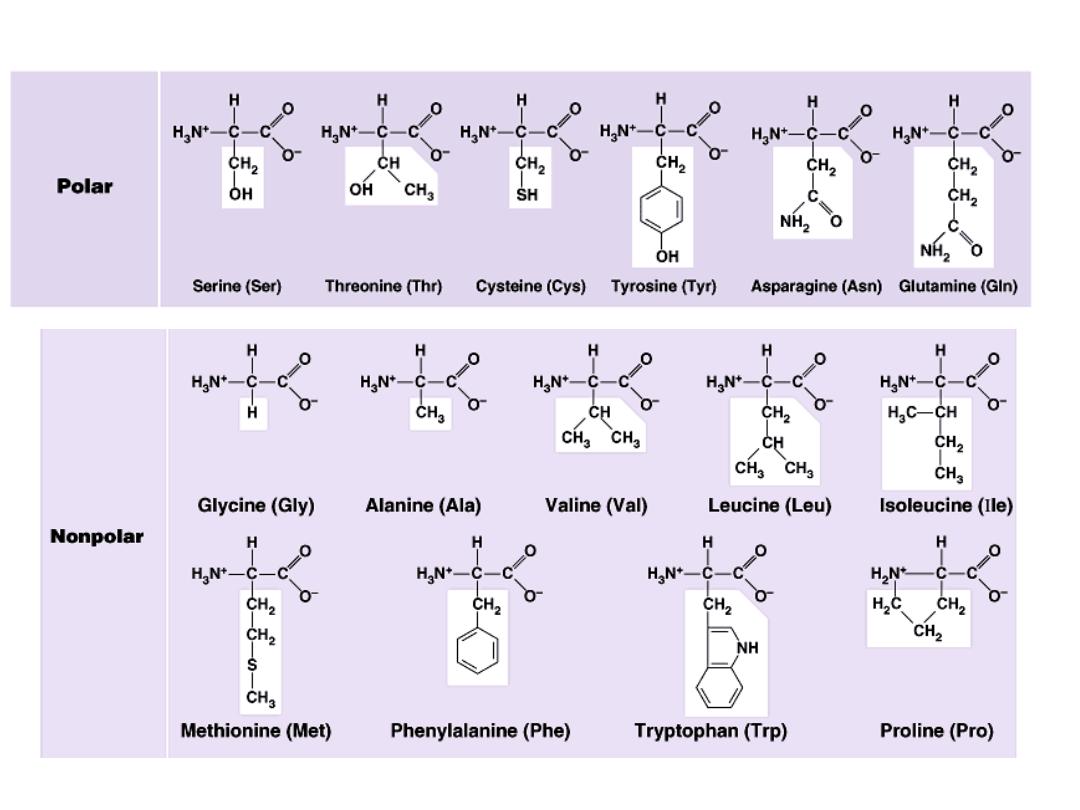
1- OH group : as in serine, threonine and tyrosine
2- SH group : as in cysteine
3- amide group: as in glutamine and aspargine
4- NH
2
group or nitrogen act as a base (basic amino acids ): as lysine,
arginine and histidine
5- COOH group ( acidic amino acids): as aspartic and glutamic .
B- Non polar amino acids:
R is alkyl hydrophobic group which can’t enter in hydrogen bond
formation. 9 amino acids are non polar ( glycine, alanine, valine,
leucine, isoleucine, phenyl alanine, tryptophan, proline and
methionine)

III- Nutritional classification:
1- Essential amino acids:
These amino acids
can’t be formed
in the body and so, it is essential to be taken in diet. Their
deficiency affects growth, health and protein synthesis.
2- Semiessential amino acids:
These are formed in the body
but not in sufficient amount for body requirements especially
in children.
Summary of essential and semiessential amino acids:
Ten
V= valine
i= isoleucine
l= lysine
l= leucine
A = arginine*
H= histidine*
M= methionine
T= tryptophan
Th= threonine P= phenyl alanine
*= arginine and histidine are semiessential
3- Non essential amino acids:
These are the rest of amino
acids that are formed in the body in amount enough for
adults and children. They are the remaining 10 amino acids.
IV- Metabolic classification:
according to metabolic or
degradation products of amino acids they may be:
1- Ketogenic amino acids:
which give ketone bodies . Lysine
and Leucine are the only pure ketogenic amino acids.
2- Mixed ketogenic and glucogenic amino acids:
which give
both ketonbodies and glucose.These are: isoleucine, phenyl
alanine, tyrosine and tryptophan.
3- Glucogenic amino acids:
Which give glucose. They include
the rest of amino acids. These amino acids by catabolism yields
products that enter in glycogen and glucose formation.

Isoelectric point (IEP) =
is the pH at which the zwitter ion is
formed. e.g IEP of alanine is 6

NITROGEN BALANCE
Nitrogen balance = nitrogen ingested - nitrogen excreted
(primarily as protein) (primarily as urea)
Nitrogen balance = 0 (nitrogen equilibrium)
protein synthesis = protein degradation, as
in normal healthy adult
Positive nitrogen balance
protein synthesis > protein degradation , as
during growth, convulaesence, lactation, and pregnancy
Negative nitrogen balance
protein synthesis < protein degradation, as
during illness, surgery.
peptides and Proteins
20 amino acids are commonly found in protein.
These 20 amino acids are linked together through
“peptide
bond forming peptides and proteins
(what’s the difference?).
- The chains containing less than 50 amino acids are called
“peptides”,
while those containing greater than 50 amino
acids are called
“proteins”.
Peptide bond formation:
α-carboxyl group of one amino acid (with side chain R1)
forms a covalent peptide bond with α-amino group of another
amino acid ( with the side chain R2) by removal of a molecule of
water. The result is : Dipeptide ( i.e. Two amino acids linked by
one peptide bond).
By the same way,
the dipeptide can then
forms a second peptide bond with a third amino acid (with side
chain R3) to give Tripeptide. Repetition of this process generates
a polypeptide or protein of specific amino acid sequence.
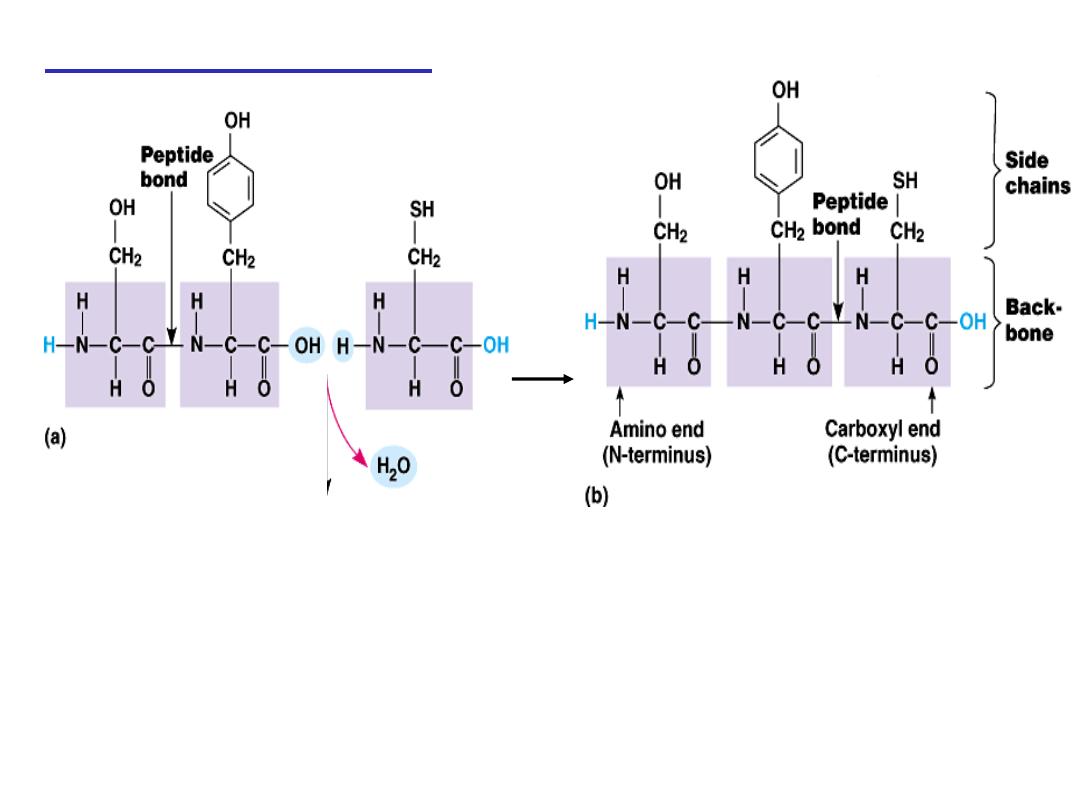
Peptide bond formation:
- Each polypeptide chain starts on the left side by free amino group of
the first amino acid enter in chain formation . It is termed (N- terminus).
- Each polypeptide chain ends on the right side by free COOH group of
the last amino acid and termed (C-terminus).

Examples on Peptides:
1- Dipeptide
( tow amino acids joined by one peptide bond):
Example:
Aspartame
which acts as sweetening agent being
used in replacement of cane sugar. It is composed of aspartic
acid and phenyl alanine.
2- Tripeptides
( 3 amino acids linked by two peptide bonds).
Example:
GSH
which is formed from 3 amino acids: glutamic
acid, cysteine and glycine. It helps in absorption of amino
acids, protects against hemolysis of RBC by breaking H
2
O
2
which causes cell damage.
3- octapeptides: (8 amino acids)
Examples:
Two hormones; oxytocine and vasopressin
(ADH).
4- polypeptides
: 10- 50 amino acids: e.g. Insulin hormone
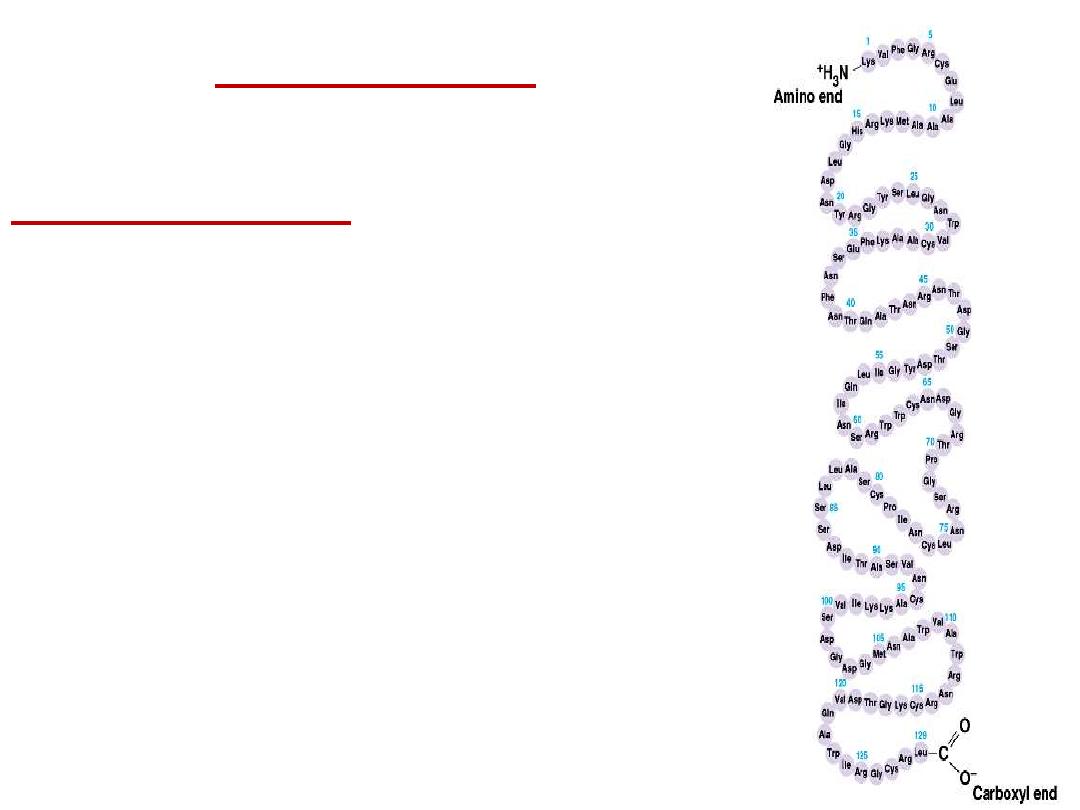
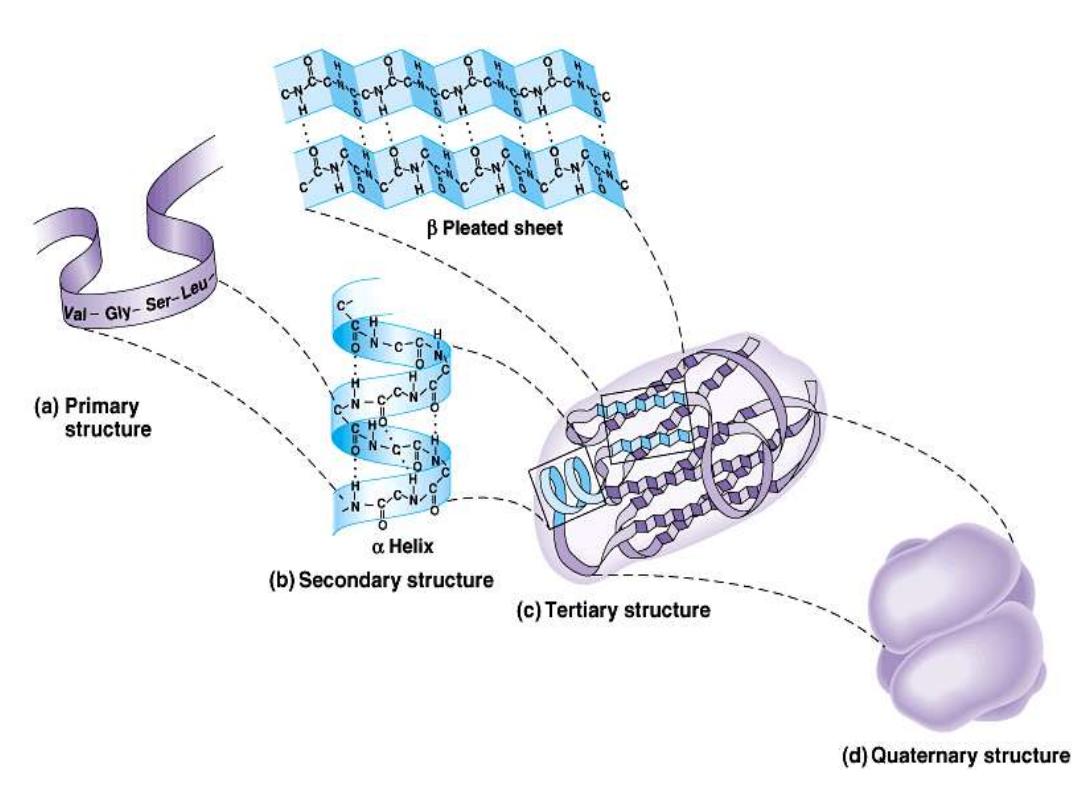
Protein structure:
There are four levels of protein structure (primary,
secondary, tertiary and quaternary)
Primary structure:
•
The primary structure of a protein is its
unique sequence of amino acids..
–
The precise primary structure of a
protein is determined by inherited
genetic information.
–
At one end is an amino acid with a free
amino group the (the N-terminus) and at
the other is an amino acid with a free
carboxyl group the (the C-terminus).
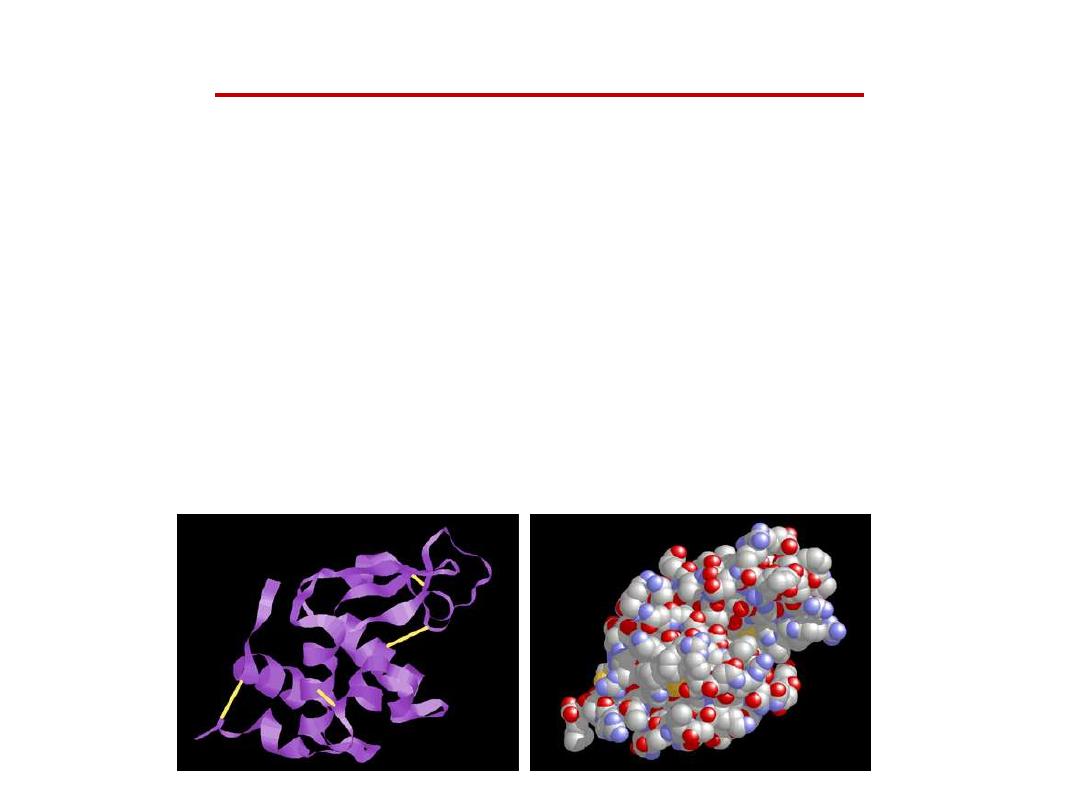
High orders of Protein structure
•
A functional protein is not just a polypeptide chain, but
one or more polypeptides precisely twisted, folded and
coiled into a molecule of unique shape (conformation).
This conformation is essential for some protein function
e.g. Enables a protein to recognize and bind specifically to
another molecule e.g. hormone/receptor; enzyme/substrate
and antibody/antigen.
•
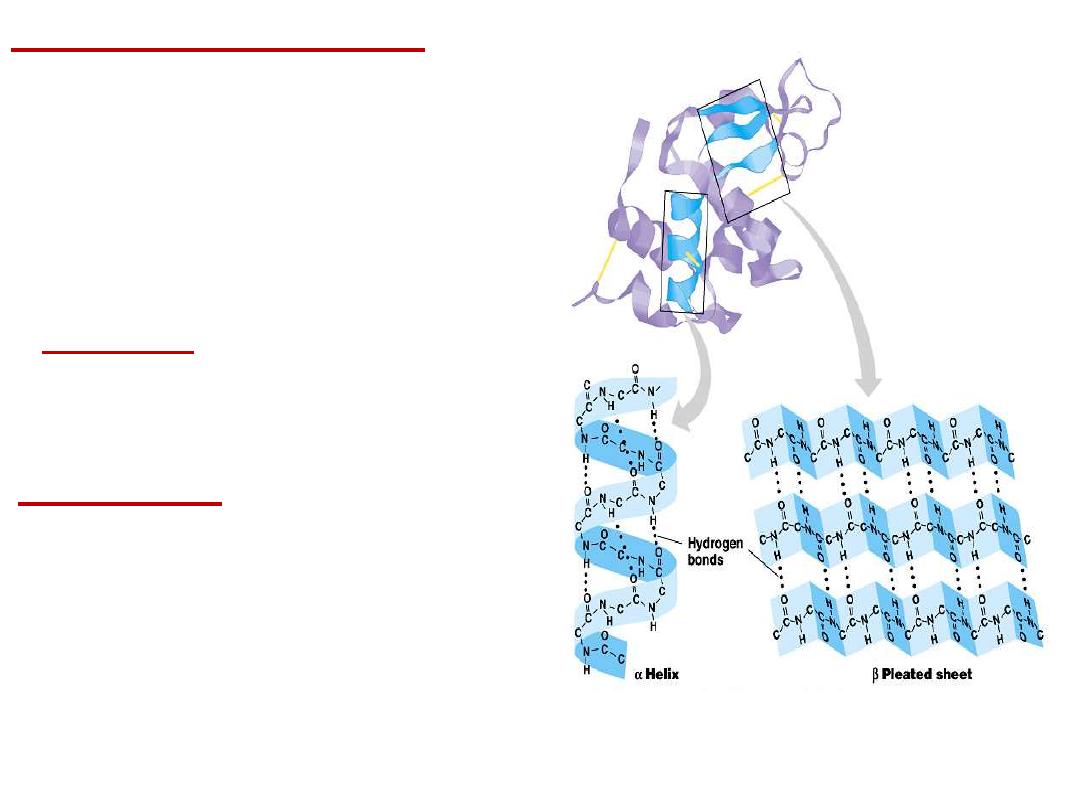
2- Secondary structure:
Results from hydrogen bond
formation between hydrogen of
–NH
group
of
peptide
bond
and
the
carbonyl oxygen of another peptide
bond. According to H-bonding there
are two main forms of secondary
structure:
α-helix:
It is a spiral structure
resulting
from
hydrogen
bonding
between one peptide bond and the
fourth one
β-sheets:
is
another
form
of
secondary structure in which two or
more polypeptides (or segments of
the same peptide chain) are linked
together by hydrogen bond between
H- of NH- of one chain and carbonyl
oxygen
of
adjacent
chain
(or
segment).
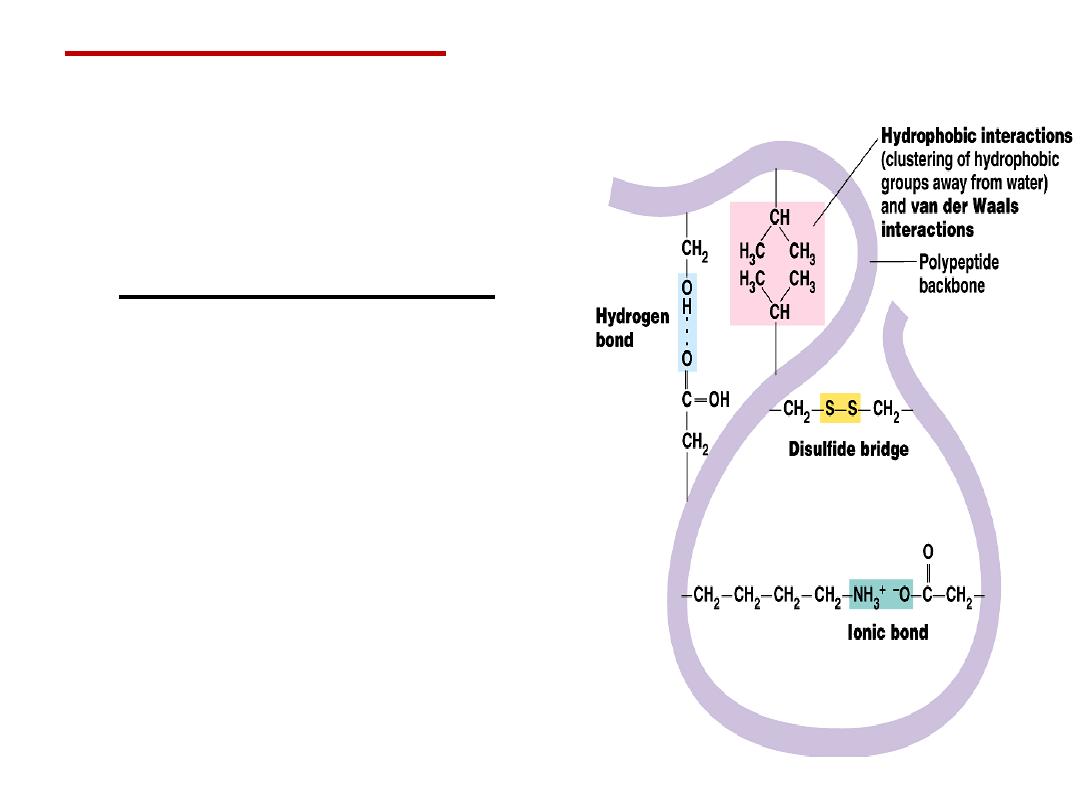
•
Tertiary structure
is
determined by a variety of
interactions (bond formation)
among R groups and between R
groups and the polypeptide
backbone.
a.
The weak interactions
include:
Hydrogen bonds among
polar side chains
Ionic bonds between
charged R groups ( basic
and acidic amino acids)
Hydrophobic
interactions among
hydrophobic ( non polar) R
groups.
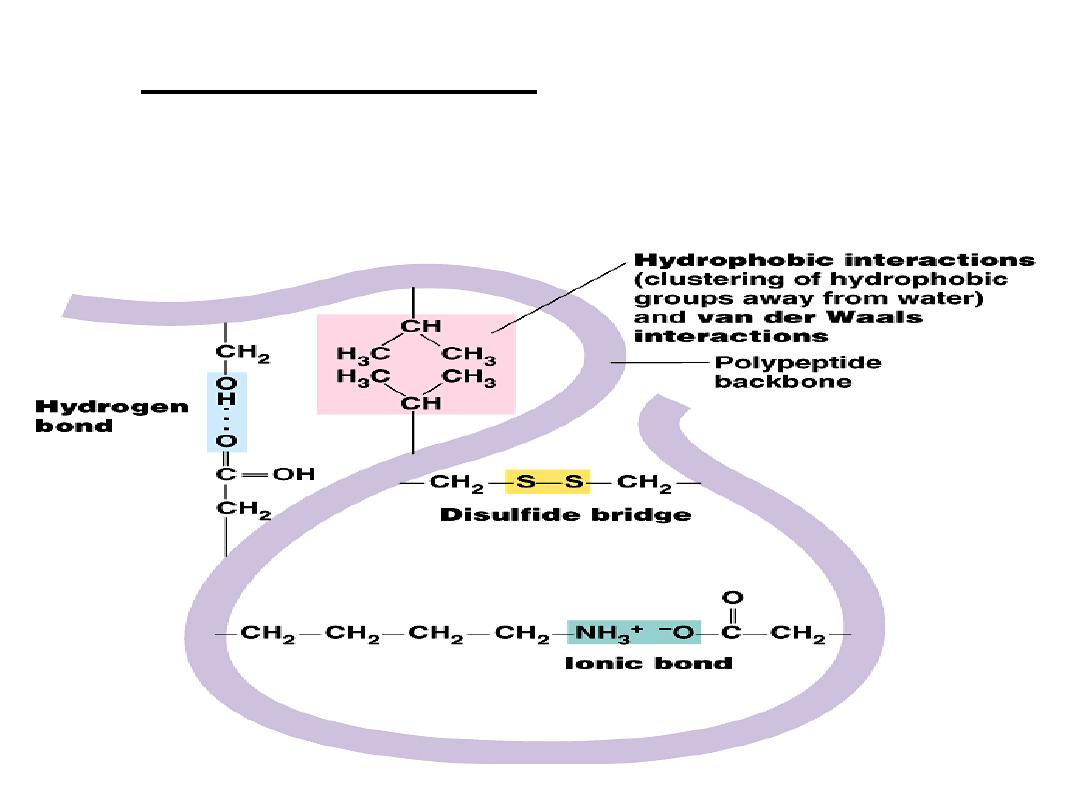
b.
Strong covalent bonds include disulfide
bridges, that form between the sulfhydryl
groups (SH) of cysteine monomers, stabilize
the structure.
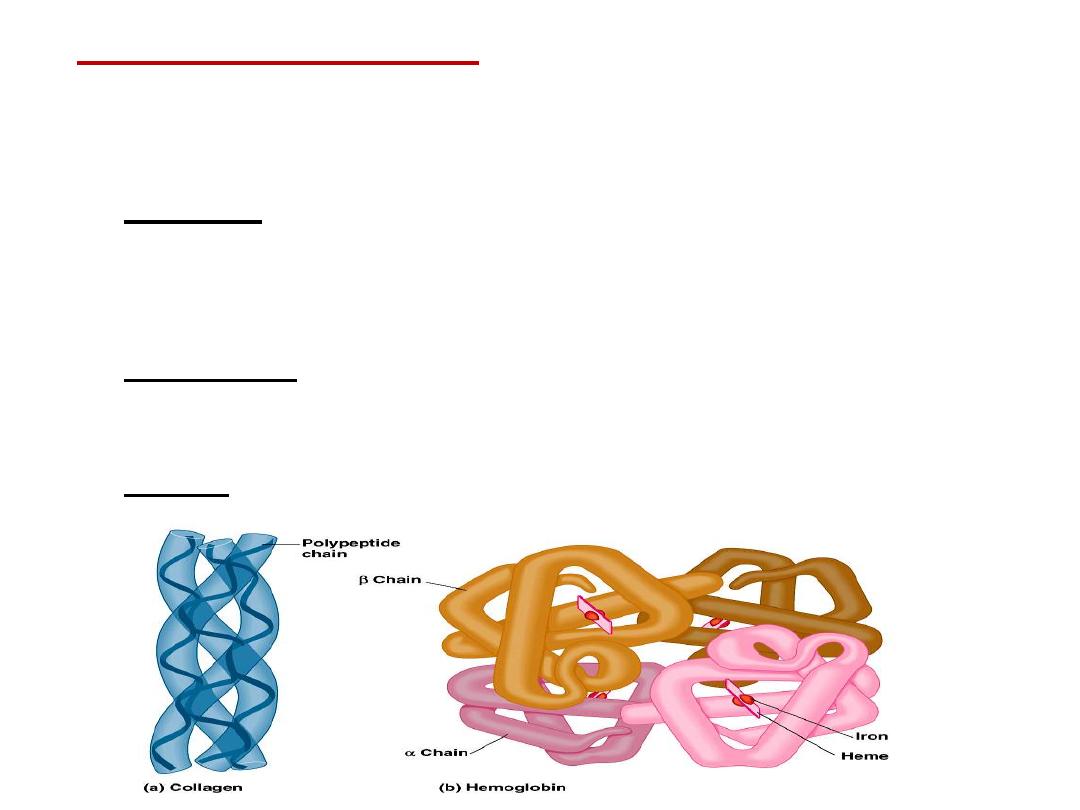
•
Quaternary structure:
results from the aggregation (combination)
of two or more polypeptide subunits held together by non-covalent
interaction like H-bonds, ionic or hydrophobic interactions.
•
Examples on protein having quaternary structure:
–
Collagen is a fibrous protein of three polypeptides (trimeric) that are
supercoiled like a rope.
•
This provides the structural strength for their role in connective
tissue.
–
Hemoglobin is a globular protein with four polypeptide chains
(tetrameric)
–
Insulin : two polypeptide chains (dimeric)

Classification of proteins
I- Simple proteins
:
i.e. on hydrolysis gives only amino acids
Examples:
1- Albumin and globulins:
present in
egg, milk and blood
They are proteins of high biological value i.e. contain all essential
amino acids and easily digested.
Types of globulins:

.
- Gliadines are the proteins present in cereals.
- Scleroproteins:
They are structural proteins, not digested.
include: keratin, collagen and elastin.
a-
α-keratin:
protein found in hair, nails, enamel of teeth and outer
layer of skin.
• It is rich in cysteine and hydrophobic (non polar) amino acids so
it is water insoluble.
b- collagens:
protein of connective tissues found in bone, teeth,
cartilage, tendons, skin and blood vessels.

• Collagen may be present as gel e.g. in extracellular
matrix or in vitreous humor of the eye.
• Collagens are the most important protein in
mammals. They form about 30% of total body
proteins.
• There are more than 20 types of collagens, the most
common type is collagen I which constitutes about
90% of cell collagens.
• Structure of collagen:
three helical polypeptide
chains (trimeric) twisted around each other forming
triplet-helix molecule.
• ⅓
of
structure
is
glycine,
10%
proline,
10%
hydroxyproline and 1% hydroxylysine. Glycine is
found
in every third position of the chain. The
repeating sequence
–Gly-X-Y-, where X is frequently
proline and Y is often hydroxyproline and can be
hydroxylysine.
Solubility: collagen is insoluble in all solvents and not digested.
• When collagen is heated with water or dil. HCl it will be
converted into
gelatin
which is soluble , digestible and used
as diet ( as jelly). Gelatin is classified as derived protein.
Some collagen diseases:
1- Scurvy:
disease due to deficiency of vitamin C which is
important coenzyme for conversion of proline into hydroxyproline
and lysine into hydroxylysine. Thus, synthesis of collagen is
decreased leading to abnormal bone development, bleeding,
loosing of teeth and swollen gum.
2- Osteogenesis Imperfecta (OI):
Inherited disease resulting
from genetic deficiency or mutation in gene that synthesizes
collagen type I leading to abnormal bone formation in babies and
frequent bone fracture in children. It may be lethal.

C- Elastin:
present in walls of large blood vessels (such as
aorta). It is very important in lungs, elastic ligaments,
skin, cartilage, ..
It is elastic fiber that can be stretched to several times as its
normal length.
Structure: composed of 4 polypeptide chains (tetramer), similar
to collagen being having 33% glycine and rich in
proline but in that it has low hydroxyproline and
absence of hydroxy lysine.
Emphysema:
is a chronic obstructive lung disease (obstruction of
air ways) resulting from deficiency of
α1-antitrypsin
particularly in cigarette smokers.
Role of
α1-antitrypsin
: Elastin is a lung protein. Smoke stimulate
enzyme called elastase to be secreted
form
neutrophils
(in
lung).
Elastase
cause destruction of elastin of lung.

α1-antitrypsin
is an enzyme (secreted from liver) and inhibit
elastase and prevent destruction of elastin. So deficiency of
α1-
antitrypsin especially in smokers leads to degradation of lung and
destruction of lung ( loss of elasticity of lung, a disease called
emphysema.
.

.
- Nucleoproteins:
These are basic proteins ( e.g. histones)
conjugated with nucleic acid (DNA or RNA).

5- Metalloproteins:
These are proteins conjugated with metal
like iron, copper, zinc, ……
