
Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
1
Antigen recognition molecules
The recognition of foreign antigens is the hallmark of the specific adaptive immune
response. Two distinct types of the molecules are involved in these processes,
including immunoglobulins (Igs) and T-cell Ag-receptor (TCR).
Diversity and heterogeneity are characteristic features of these molecules. In both
cases, there is evidence of extensive gene-rearrangements which generate Igs or TCR
capable of recognizing many different Antigens.
A) Immunoglobulins (Ig):
Immunoglobulins, also known as antibodies (Ab) are group of glycoproteins present
in the serum or tissue fluids of all mammals, including human. They are produced by
B-lymphocytes when the host in contact with immunogenic foreign molecules
(antigens). They act as a critical part of the immune response by specifically
recognizing and binding to particular antigens, such as bacteria or viruses, and aiding
in their destruction.
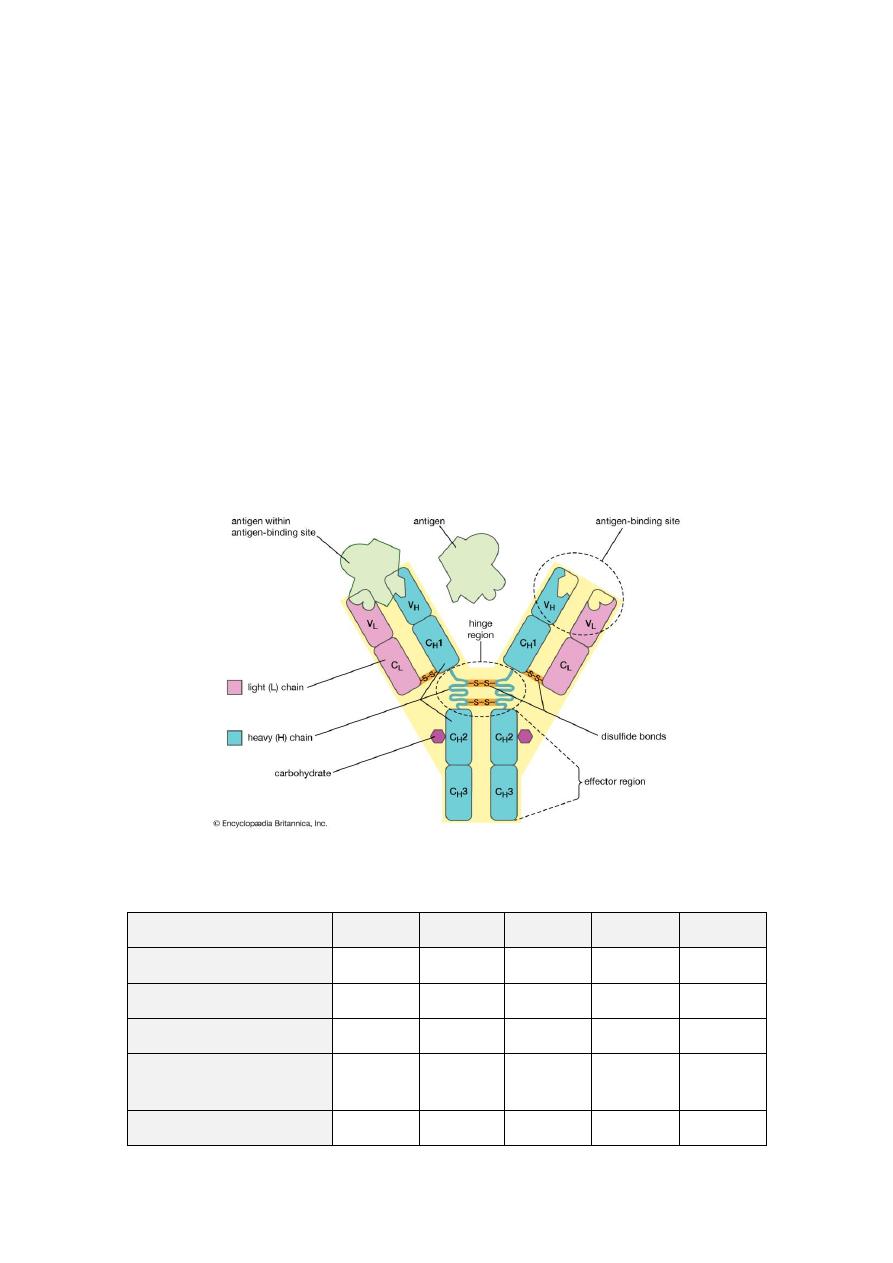
Structure of Igs
Five distinct classes of Ig molecules are recognized, namely IgG, IgM, IgA, IgD and
IgE. Each molecule has two functional regions, a fragment of Ag-binding (Fab) and a
fragment crystallizable region (Fc) mediate so called effector's functions. Fab region
is a region of the antibody that binds to antigens. It is composed of one constant and
one variable domain of each of the heavy and the light chain. Fab region contains
variable sections that define the specific target that the antibody can bind. Fc region is
a tail region of an antibody that interacts with cell surface receptors called Fc
receptors and some proteins of the complement system like CIq. Fc region of all
antibodies in a class are the same for each species; they are constant rather than
variable.
The class and subclass of the Ig molecule are determined by its heavy chain type.
Thus, the four human IgG (1, 2, 3&4) have heavy chain called gamma1, 2, 3&4, the
two human IgA (1&2) have heavy chains called alpha 1&2. but none have been
described for IgM (mu-chain), IgD (delta-chain) or IgE (epsilon-chain).
All Igs are glycoproteins, but the carbohydrate content ranges from 2-3% for IgG, to
12-14% for IgM, IgD & IgE. IgG is the major Ig in normal human serum, accounting
for 70-75% of the total Ig-Pool, followed by IgA which represents 15-20% of the
human serum Ig-pool, then IgM which accounts for approximately 10% of the Ig-
pool, then IgD which counts for less than 1% of the total plasma Ig but is a major
component of the surface membrane of many B-cells. IgE, though scarce in serum, is
found on the surface membrane of basophiles and mast cells in all individuals.
The basic four chain model for Ig molecule is based on two distinct types of
polypeptide chain. The smaller (light) chain is common to all classes and show to
exist in two distinct forms called kappa (κ) or lambda (λ), whereas, the larger (heavy)
chain which is structurally distinct for each class or subclass and called gamma (γ) in
IgG, alpha (α) in IgA, Mu (μ) in IgM, delta (δ) in IgD, and epsilon (ε) in IgE. Each
chain consists of two parts, the N-terminal of the chain shows much sequence
Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
2
variability and known as variable region (V) and c-terminal of the chain which is
constant and called constant region (C). The constant portion of the heavy chain is
further divided into three structurally discrete regions:CH1, CH2, CH, these globular
regions stabilized by intrachain disulphide bound and are referred to as “Domains”.
The hinge region is a segment of heavy chain between the CH1 and CH2-domains,
flexibility in this area permits the two Ag-binding sites to operate independently.
All light chains have one variable and one constant region. Whereas, gamma chain,
delta-chain ands alpha chain consist of three domains and the mu and epsilon chains
of IgM and IgA have an extra constant region domain. IgA and IgM have additional
peptide chain, the J (joining) chain, thought to assist the processes of polymerization.
If j-chains are not freely available, there is evidence that hexameric IgM becomes the
preferred form. Secretary IgA made up of two units of IgA, one secretary component
and one j-chain. Secretary component is not synthesized by plasma cells but by
epithelial cells. Bound secretary component facilitates the transport of S-IgA into
secretions, as well as protecting it from proteolytic attack.
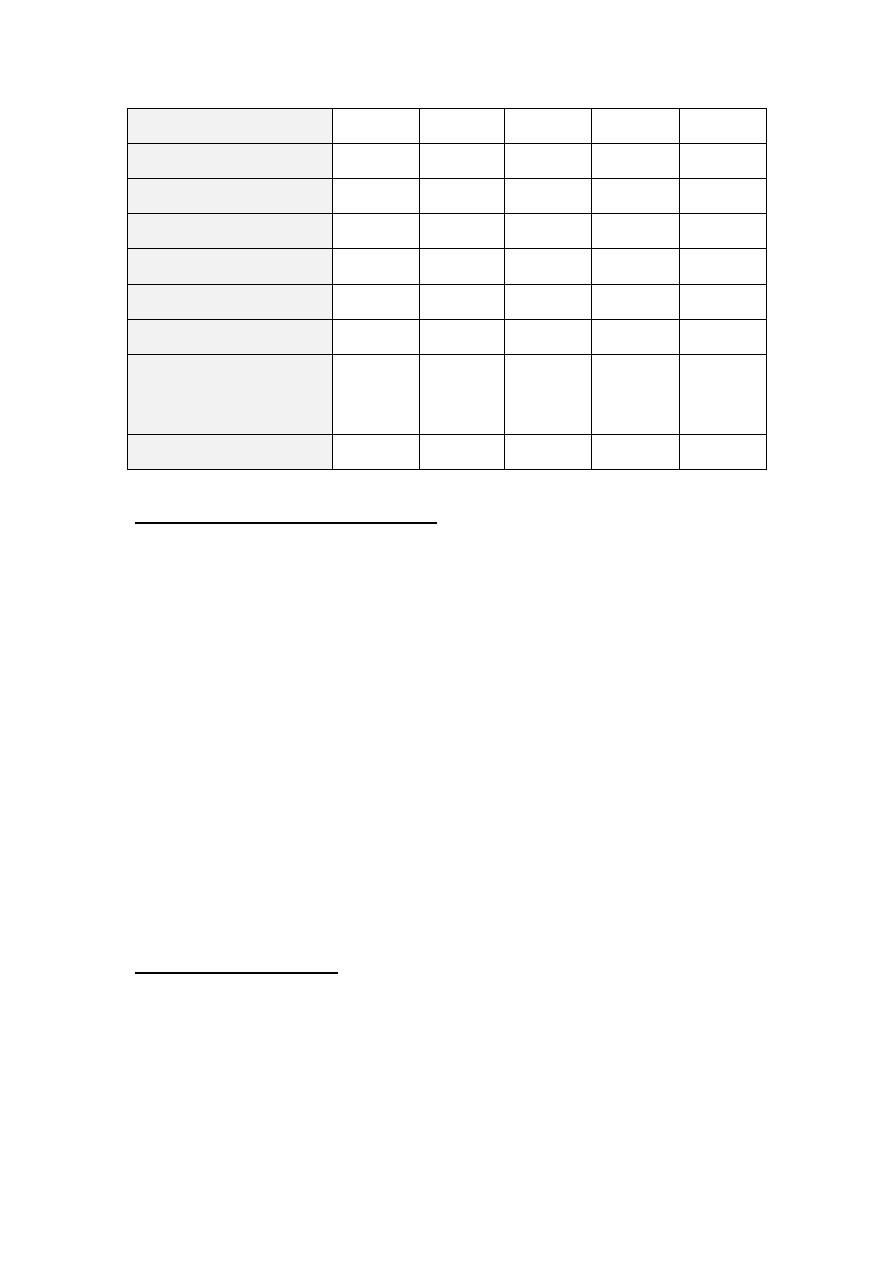
Properties of Igs: The table below shows the properties of Igs
Properties
IgG
IgM
IgA
IgE
IgD
%in serum
75
9
15
0.004
0.2
M.W (X1000)
160
900
170-400
190
180
Half life
23
5
6
2.5
3
Molecular form
Monomer Pentamer Monomer
or dimer
Monomer Monomer
Subclasses
4
2
2
1
1
Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
3
H chain
γ
μ
α
ε
δ
J chain
-
+
+
-
-
Secretory piece
-
-
+
-
-
Complement fixation
+
++
-
-
-
Crosses placenta
+
-
-
-
-
Mediates allergy
-
-
-
+
-
Opsonization
+
_
-
-
-
Binds to Fc receptor in
NK cells or phagocytes
(ADCC)
+
-
-
-
-
Ag receptor on B cells
-
+
-
-
±
Interaction of antibodies with antigens:
The binding of Ag to Ab involves the formation of multiple non-covalent bounds
between the Ag and amino acids of the binding site. The attractive forces (hydrogen
and electrostatic bounds, Van der Waals and hydrophobic forces) are weak by
comparison with covalent bounds. However, the large number of interaction results in
a large total binding energy.
The strength of a non-covalent bond is critically dependent on the distance between
the interacting groups and in order for epitope and an Ab-combing site (paratope) to
combine, there must be suitable atomic groupings on both parts (Ag & Ab) and the
shape of the combining site must fit the epitope. The steric repulsive forces come into
play since it is inversely proportional to the distance between the electron clouds.
These forces that determining the specificity of the Ab for a particular Ag.
The strength of the single bond between Ag and Ab is known as the Ab-affinity, it is
the sum of the attractive and repulsive forces, whereas the overall strength of
interaction between the Ab and Ag indicates Ab-avidity. The avidity is likely to be
more relevant than affinity, as naturally occurring Ags are multivalent. When some of
the epitopes of an Ag are shared by another Ag then a proportion of the Abs directed
to that Ag and this phenomenon is termed cross-reactivity.
Function of the antibodies:
Major functions of the antibodies are:
1. Neutralization of infectivity:
Antibodies are secreted into the blood and mucosa, where they can block the
infectivity of pathogens (bacteria, viruses, parasites and fungi), inactivate or
neutralize foreign substances such toxins. Neutralization generally occurs as a result
of interfering with an organism’s attachment to host tissues.
Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
4
some antibodies have been shown to inhibit infectivity by binding to organisms and
causing them to aggregate. Aggregation or agglutination by IgA may allow more
efficient entrapment of bacteria in mucous and subsequent clearance by peristalsis.
Although aggregation is more likely to occur with polymeric IgA and IgM, some
neutralizing IgG antibodies can aggregate polio virus and reduce the infectivity.
Similarly, Antibodies against HIV-1 gp120 interfere with binding of gp120 to CD4.
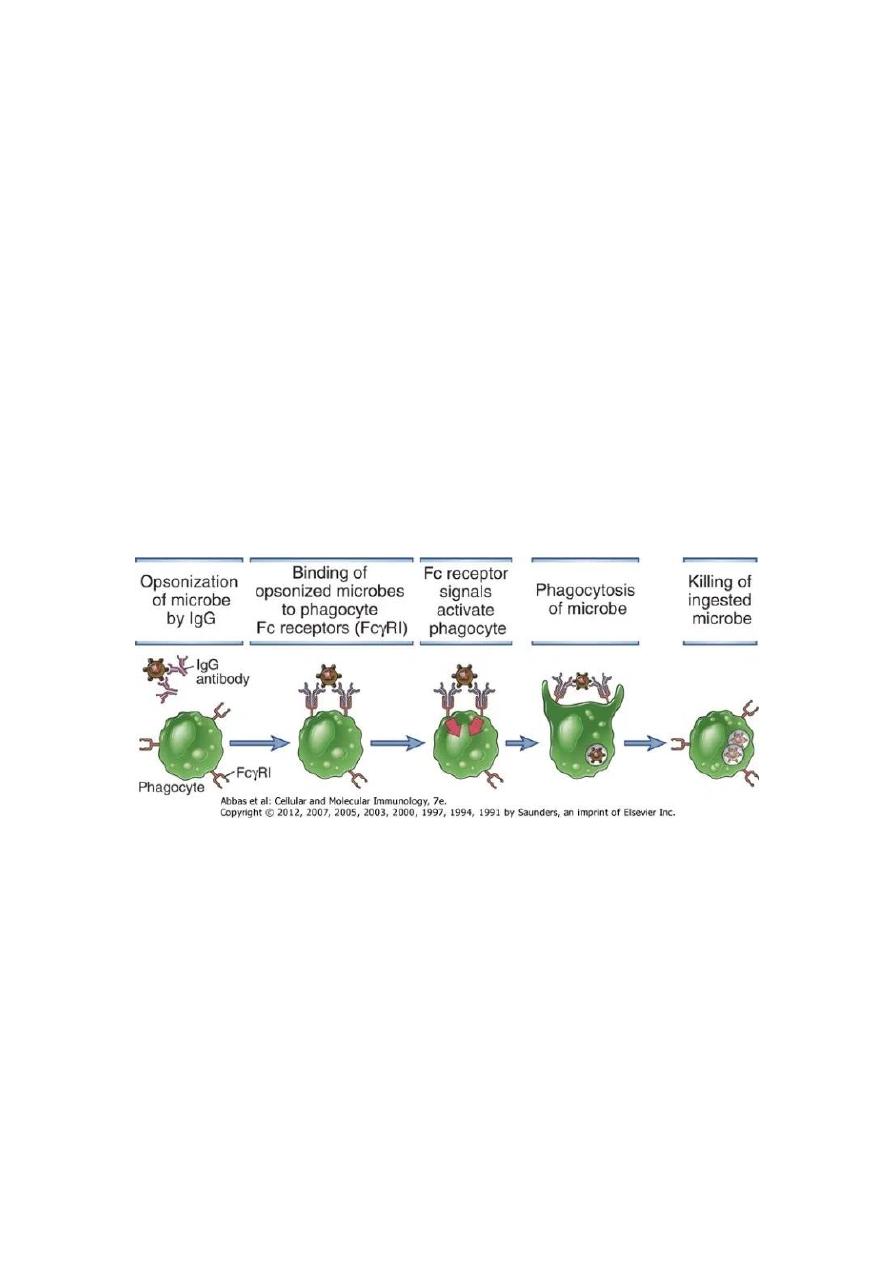
2. Phagocytosis:
Antibodies facilitate phagocytosis of foreign substances by a process called
opsonization. The internalization and degradation of antibody-coated pathogens by
macrophages and neutrophils via FcRs (Fc receptors are protein molecules present on
the surfaces of macrophages and neutrophils which can bind the constant region of
immunoglobulin molecules) is a critical antibody function for clearance of pathogens
in vivo.
The binding of phagocyte Fc receptors with several antibody molecules complexed
with the same target initiates a signal transduction pathway that results in the
phagocytosis of the antigen-antibody complex. Inside the phagocyte, the pathogen
becomes the target of various destructive processes that include oxidative damage,
enzymatic digestion, membrane disrupting effects of antibacterial peptides etc.
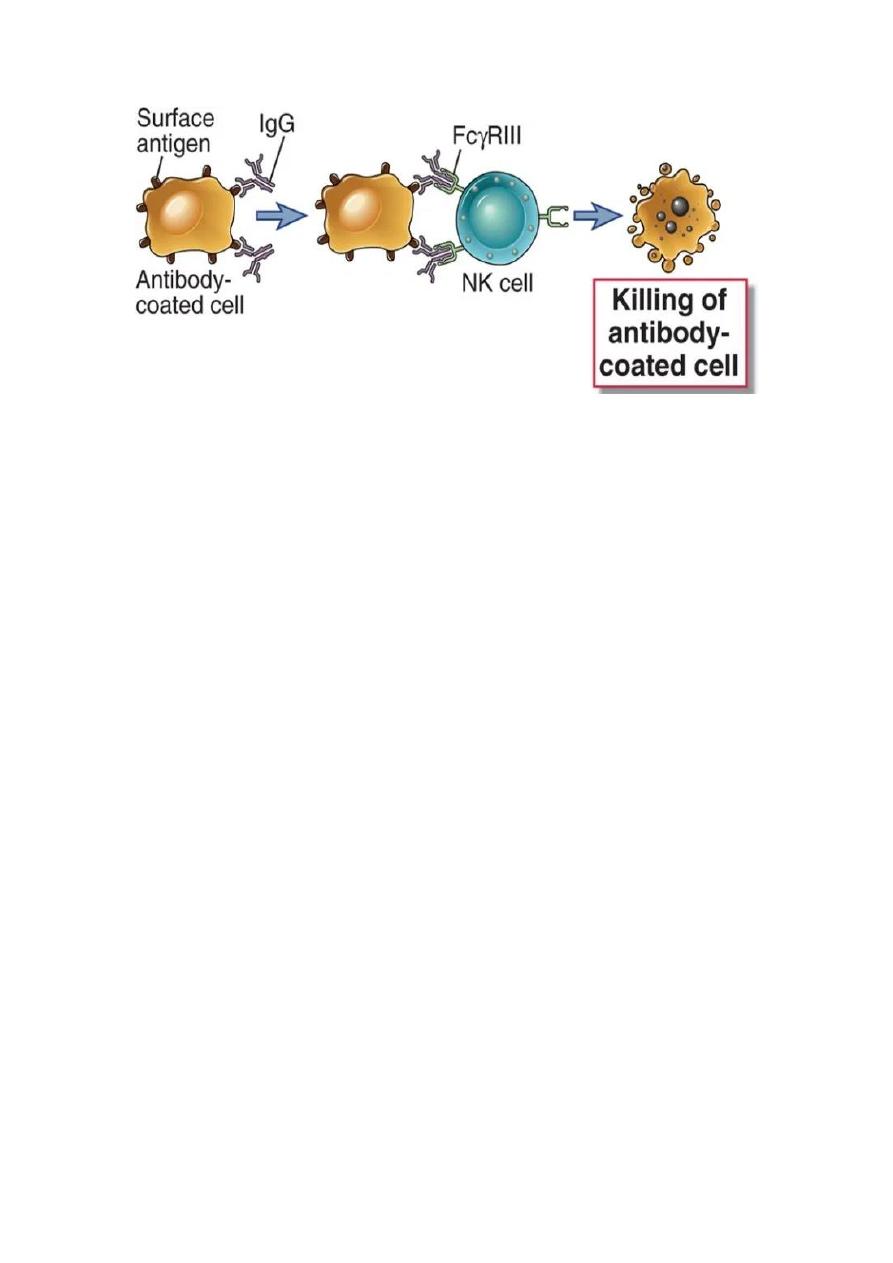
3. Antibody-dependent cellular cytotoxicity (ADCC):
Antibodies have shown anti-microbial activity either directly or through interactions
with FcRs or complement. ADCC occurs when antibody forms a bridge between an
infected target cells (virus infected cells of the host) and an FcR-bearing effector cell,
particularly natural killer (NK) cells. The result of this three-way interaction is the
death of the target cell, either by lysis or apoptosis.
Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
5
4. Complement-mediated lysis of pathogens or of infected cells: Antibodies
activate the complement system to destroy bacterial cells by lysis
Antibodies (IgM and most IgG subclasses) activate the complement system which can
result in the lysis of organisms or of infected cells. An important byproduct of the
complement cascade is C3b, which is a protein fragment that can bind nonspecifically
to cell and Ag-Ab complexes. Many cell types, for example, red blood cells or
macrophages have receptors for C3b and so bind cells or complexes to which C3b has
adhered.
Binding of Ag-Ab complexes by the C3b receptors of an RBC allows it to deliver the
complexes to liver or spleen where resident macrophages remove them without
destroying red blood cell. In addition, organisms or Ag-Ab complexes bound by
complement can be internalized by phagocytic cells, with the resultant clearance.
Internalization through complement receptors on antigen-presenting cells (APCs) can
also result in the processing of antigen for presentation to T lymphocytes.
5. Transcytosis, mucosal immunity & neonatal immunity
Some antibodies can move across epithelial layers (depends on the property of the
constant region of that antibody molecule) via a process called transcytosis. IgA is the
major immunoglobulin that undergoes transcytosis and is available in secretory form
(sIgA) in the mucosal surfaces of respiratory, gastrointestinal and urogenital tracts.
In mammalian species including humans, most subclasses of IgG can cross the
placental barrier (since maternal and fetal circulatory system are separate) thus
conferring sample of mother’s repertoire of antibody to the developing fetus as
protective endowment against pathogens. This passive immunization of developing
fetus occurs during the third trimester of gestation.

Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
6
Type of Antibody Major Function (s)
IgG
Opsonization, Complement Activation, Antibody dependent cell mediated
cytotoxicity, Neonatal immunity, Feedback inhibition of B cells
IgA
Mucosal Immunity
IgM
Naive B cell antigen receptor, complement activation
IgD
Naïve B cell receptor
IgE
Defense against helminthic parasites, immediate hypersensitivity
diversity:
-
Generation of Ab
Abs are remarkably diverse and provide enough different combining sites to
recognize the millions of antigenic shapes in the environment. In fact, we produce
more types of Ab than there are genes in our genome. All these diversities generated
by:
• Multiple V-region genes in the germ line; i.e many gene coding for the
variable (V) region.
• Somatic recombination between elements forming a V-region gene. i.e a
number of gene segments could recombine to give a complete V-gene.
• Gene conversion; a panel of pseudo genes can also be used to alter the
sequences within the variable region.
• Nucleotide addition; during cutting and joining of the DNA extra nucleotides
may be inserted.
• Somatic mutation; so the relatively few genes give rise to many mutated genes
during the lifetime of the individual.
Mammals may use all five mechanisms to generate diversity and another
possible mechanism like recombinational inaccuracies and assorted heavy and light
chain. In humans the genes encoding kappa and lambda light chains are found on
chromosomes 2 and 22 respectively whereas, the heavy chain gene locus is found on
chromosome 14. the genes for isotypic variants are gamma 1,2,3&4 , mu, alpha1&2,
delta, epsilon, kabba and lambda-chain genes, all present in human geneome (Isotypic
varation). Thus, isotypic variation is present in the germ line of all members of a
species, producing the heavy and light chains and the V-region framework
(Subgroups). Allotypic variation is interspecies allelic variability. Allotypes occur
mostly as variants of heavy chain constant regions. It is not found in all people and is
therefore an allotype.
The idiotypic variation refers to the diversity at the Ag-binding site (paratope)
and in particular relates to the hyper variable segments. These determine the binding
specificity of the Ag-binding site. The hyper variable regions are sometimes referred
to as complementarity determining region (CDRs).

Dr Dhafer A. Alghezi
Lecture 4: Antigen recognition molecules
7
Immunoglobulin gene recombination:
Light chain genes recombine V and J segments to make a gene for the VL
domain. Whereas, heavy chain genes recombine V, D and J gene segments to make a
gene for the VH domain.
Several Vk-genes on the germ line DNA (V1-Vn) and Jk segment (Jk1-Jk5) and only
one constant-region (k-gene). But in the lambda-gene a set of V-genes (v1-Vn), just
one J-gene and seven C-genes. Rearrangement of the V and J genes recombined with
–region to form light chain.
Also in the heavy chain region the variable region encoded by V and J
segments genes and a third gene segment, the D (diversity)-segment gene. The D is
highly variable both in number and sequence of base paired.
VH (V1-Vn), DH (D1-D30), J (J1-J6). More than one D-segment may join to
form an enlarged D-region. Eighty seven VH segments are found on chromosome 14,
of which at least 32 are pseudo genes. The recombination of V,D,J segments in the
heavy chain is largely responsible for the variability of CDRs. The place at which V
& J segment gene join may vary slightly and these slight variations in the position of
recombination generate additional diversity.
Somatic mutation:-
The Ig heavy and light chain genes undergo structural modifications after Ag-
stimulation. There is some evidence that V-region is particularly mutable. The
somatic mutation occurs in germinal centers to produce a higher-affinity Ab. This
process called affinity maturation. So the potential for increased diversity multiplies at
each step of Ig-production.
2. T cell antigen Receptor (TCR):
