
Pathology of the small
and large intestine

Abdominal Hernia
Any weakness or defect in the wall of the
peritoneal cavity may permit protrusion of a
serosa-lined pouch of peritoneum called a
hernia sac.
Acquired hernias most commonly occur
anteriorly, through the inguinal and femoral
canals or umbilicus, or at sites of surgical scars.
These are of concern because of visceral
protrusion (
external herniation
).

Inguinal hernias
It tend to have narrow orifices and large sacs.
Small bowel loops are herniated most often, but
portions of omentum or large bowel also
protrude, and any of these may become
entrapped.
Pressure at the neck of the pouch may impair
venous drainage, leading to stasis and edema.
These changes increase the bulk of the herniated
loop, leading to permanent entrapment
and over
time, arterial and venous compromise, or
strangulation,
can result in infarction.

Vascular disorders of bowel
The greater portion of the gastrointestinal tract is
supplied by the celiac, superior mesenteric, and inferior
mesenteric arteries.
As they approach the intestinal wall, the superior and
inferior mesenteric arteries fan out to form the
mesenteric arcades.
Interconnections between arcades, as well as collateral
supplies from the proximal celiac and distal pudendal and
iliac circulations, make it possible for the small intestine
and colon to tolerate slowly progressive loss of the blood
supply from one artery.
By contrast, acute compromise of any major vessel can
lead to infarction of several meters of intestine.

Ischemic bowel disease
• Ischemic damage to the bowel wall can range from
mucosal infarction,
extending no deeper than the
muscularis mucosa;
to
mural infarction
of mucosa
and submucosa; to
transmural infarction
involving
all three layers of the wall.
• Mucosal or mural infarctions often are secondary
to acute
or chronic
hypoperfusion,
transmural
infarction is generally
caused by acute vascular
obstruction.

Causes of
acute arterial obstruction
• Severe
atherosclerosis
(which is often prominent at
the origin of mesenteric
vessels),
aortic aneurysm.
•
Hypercoagulable states, oral contraceptive use.
•
Embolization of cardiac vegetations or aortic
atheromas.
Causes of intestinal hypoperfusion
•
Cardiac failure.
•
Shock.
•
Dehydration.
•
Vasoconstrictive drugs.
Damage intestinal arteries
Systemic
vasculitides,
such as polyarteritis nodosum,
Henoch-Shonlein purpura, or Wegener granulomatosis.

PATHOGENESIS
Intestinal responses to ischemia occur in two phases.
The initial hypoxic injury occurs at the onset of vascular
compromise and, although some damage occurs,
intestinal epithelial cells are relatively resistant to
transient hypoxia.
, is initiated by
reperfusion injury
The second phase,
restoration of the blood supply and associated with the
greatest damage. In severe cases multiorgan failure may
occur. While the underlying mechanisms of reperfusion
injury are incompletely understood, they involve free
radical production, neutrophil infiltration, and release of
inflammatory mediators, such as complement proteins
and cytokines.

• The severity of vascular compromise, time frame
during which it develops, and vessels affected are
the major variables that determine severity of
ischemic bowel disease.

Tumors of the small and large intestine:
Non neoplastic polyp:
Adenoma:
Familial polyposis syndrome:
Colorectal carcinoma:
Gastrointestinal lymphoma:
GIST:
• Polyps
• Polyps are most common in the colon but may occur
in the esophagus, stomach, or small intestine.
•
sessile
, grow directly from the stem without a stalk.
•
pedunculated
Polyps with stalks.
• Intestinal polyps can be classified as non-neoplastic or
neoplastic in nature.
• The most common neoplastic polyp is the adenoma,
which has the potential to progress to cancer.
• The non-neoplastic polyps can be classified as
inflammatory, hamartomatous, or hyperplastic.
Non neoplastic Polyps
Hyperplastic
• Asymptomatic.
• Less than 5 mm.
• Single or multiple.
• Rectosigmoid.
• No malignant
potential.
Hamartomatous
• Peutz-Jegher (AD)
• Multiple, whole of GIT
• Mucocutaneous pigment.
• Risk of GI and non-GI Ca.
• Juvenile:
• children < 5Y, quite large.
• Rectum.
• No malignant potential.

Inflammatory polyps
Solitary rectal ulcer syndrome
.
Patients present with a clinical triad of rectal bleeding, mucus
discharge, and an inflammatory lesion of the anterior rectal
wall.
The underlying cause is impaired relaxation of the anorectal
sphincter that creates a sharp angle at the anterior rectal shelf
and leads to recurrent abrasion and ulceration of the
overlying rectal mucosa. An inflammatory polyp may
ultimately form as a result of chronic cycles of injury and
healing.
Entrapment of this polyp in the fecal stream leads to mucosal
prolapse.
Histologic features:
Inflammatory polyp with superimposed mucosal prolapse
and include lamina propria fibromuscular hyperplasia, mixed
inflammatory infiltrates, erosion, and epithelial hyperplasia.
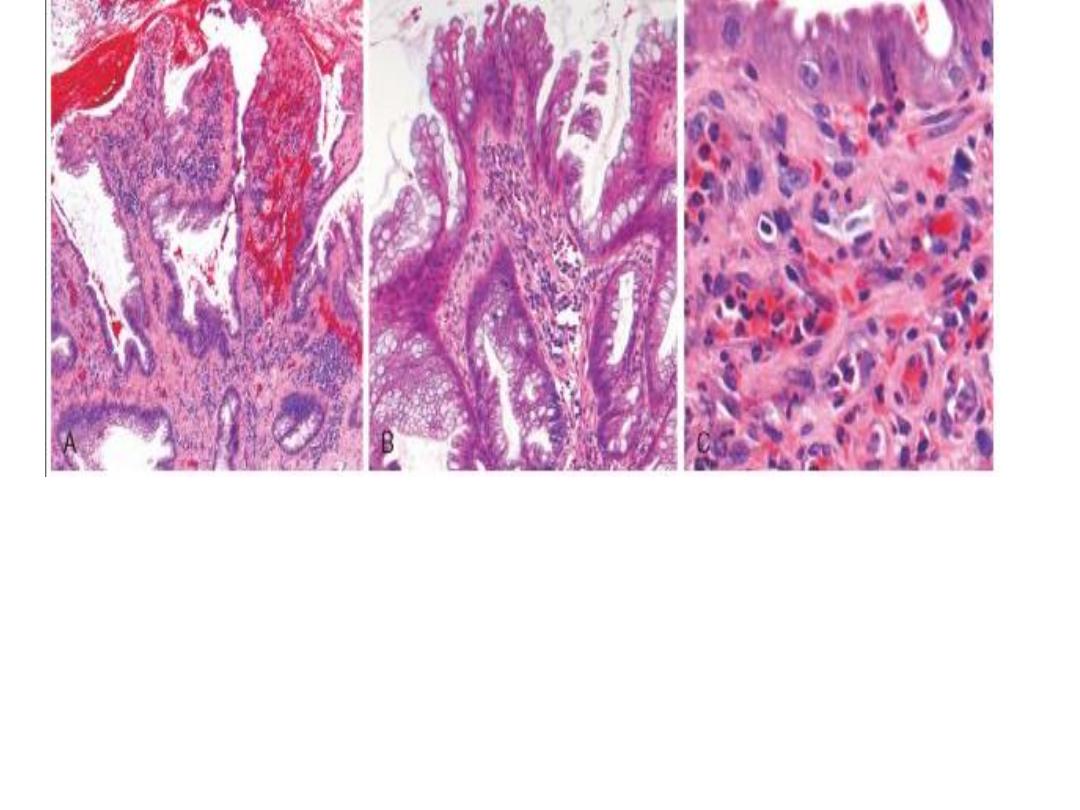
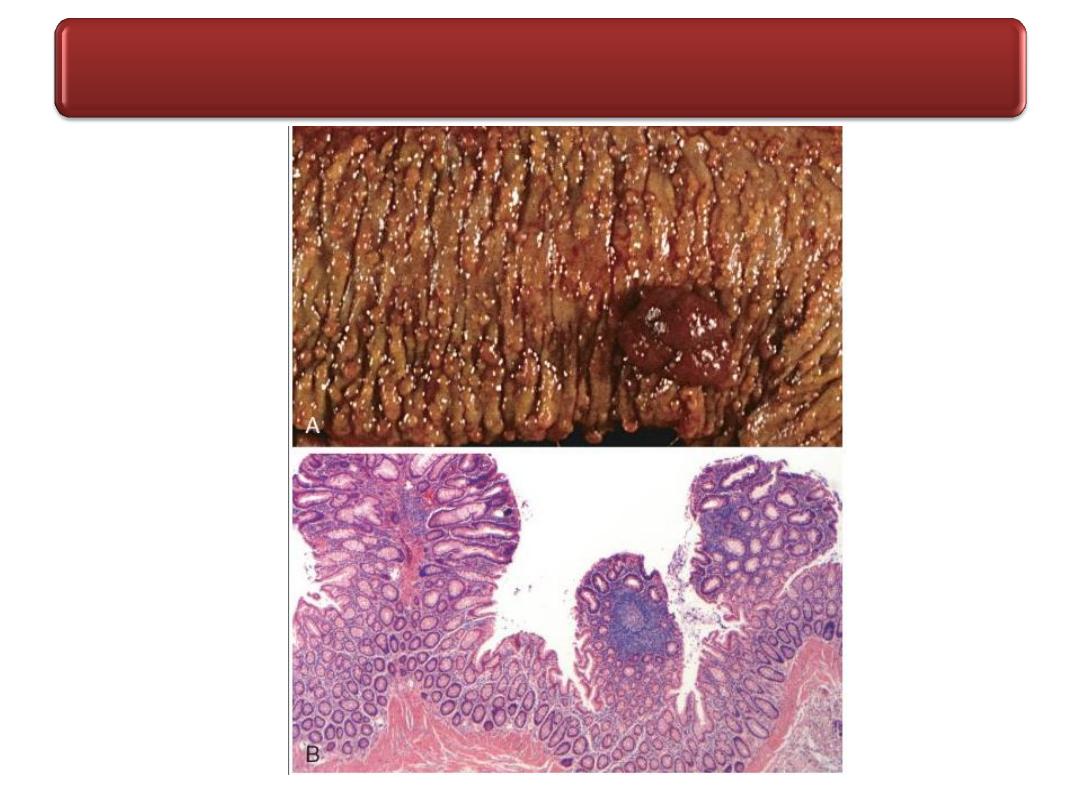
Solitary rectal ulcer syndrome.
A, The dilated glands, proliferative epithelium, superficial erosions, and
inflammatory infiltrate are typical of an inflamatory polyp.The smooth muscle
hyperplasia within the lamina propria suggests that mucosal prolapse has also
occurred.
B, Epithelial hyperplasia.
C, Granulation tissue-like capillary proliferation within the lamina propria caused
by repeated erosion and re-epithelialization

• Hamartomatous polyps
• It’s occur sporadically and in the context of various
genetically determined or acquired syndromes.
• Hamartomas are tumor-like growths composed of
mature tissues that are normally present at the site
in which they develop.
• Hamartomatous polyposis syndromes are rare,
they are important to recognize because of
associated intestinal and extra-intestinal
manifestations and the possibility that other family
members are affected.
Hyperplastic polyps
Common epithelial proliferations.
Discovered in the sixth and seventh decades of life.
Pathogenesis of hyperplastic polyps is incompletely
decreased
they are thought to result from
understood, but
epithelial cell turnover and delayed shedding of surface
epithelial cells, leading to a “piling up” of goblet cells and
absorptive cells.
These lesions are without malignant potential.
they must be distinguished from sessile serrated adenomas,
histologically similar lesions that have malignant potential
.
It is also important to remember that epithelial hyperplasia
can occur as a nonspecific reaction adjacent to or overlying
any mass or inflammatory lesion and, therefore, can be a clue
to the presence of an adjacent, clinically important lesion.

Morphology
Gross:
Hyperplastic polyps are most commonly found in the left
colon and are typically less than 5 mm in diameter.
They are smooth, nodular protrusions of the mucosa,
often on the crests of mucosal folds.
Single or multiple, particularly in the sigmoid colon and
rectum.
Microscopically:
Hyperplastic polyps are composed of mature goblet and
absorptive cells.
The delayed shedding of these cells leads to crowding
architecture that is the
serrated surface
that creates the
morphologic hallmark of these lesions.
Adenomatous Polyps
epithelial proliferation and dysplasia
Four types: tubular, villous, mixed, and sessile
serrated adenoma.
Risk of malignancy related to size, histologic type, and
dysplasia
Since they are considered premalignant, all should be
removed.
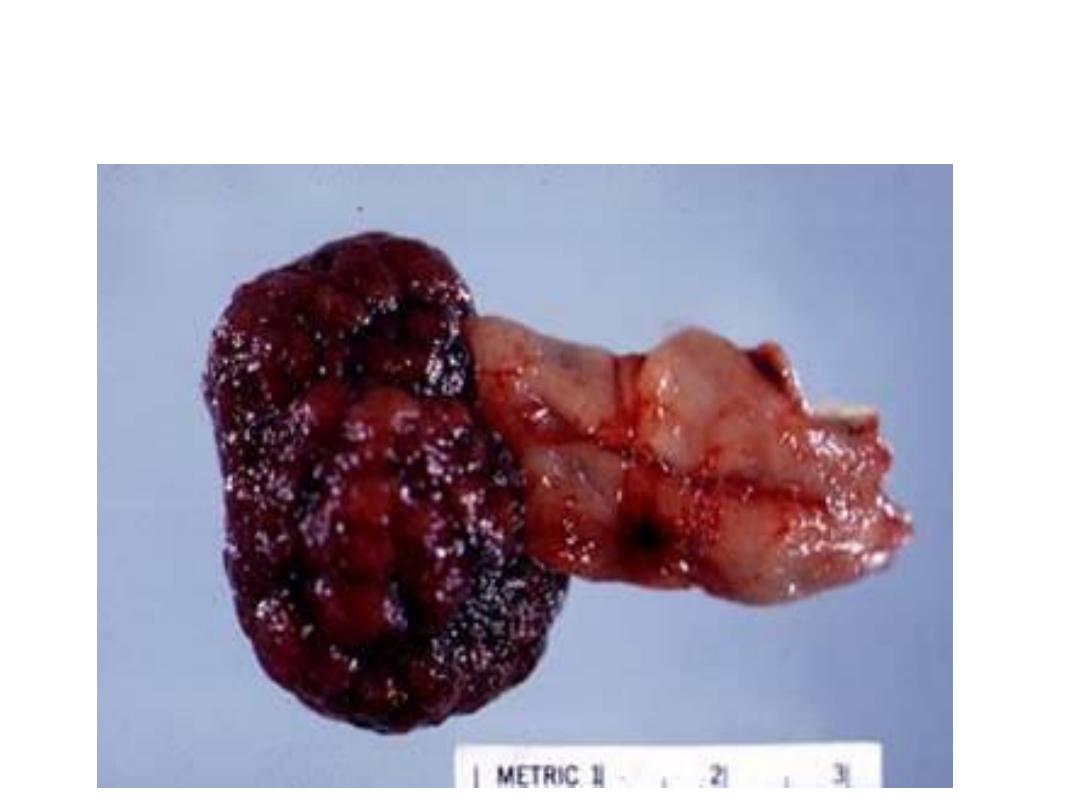
Large pedunculated adenomatous colonic polyp
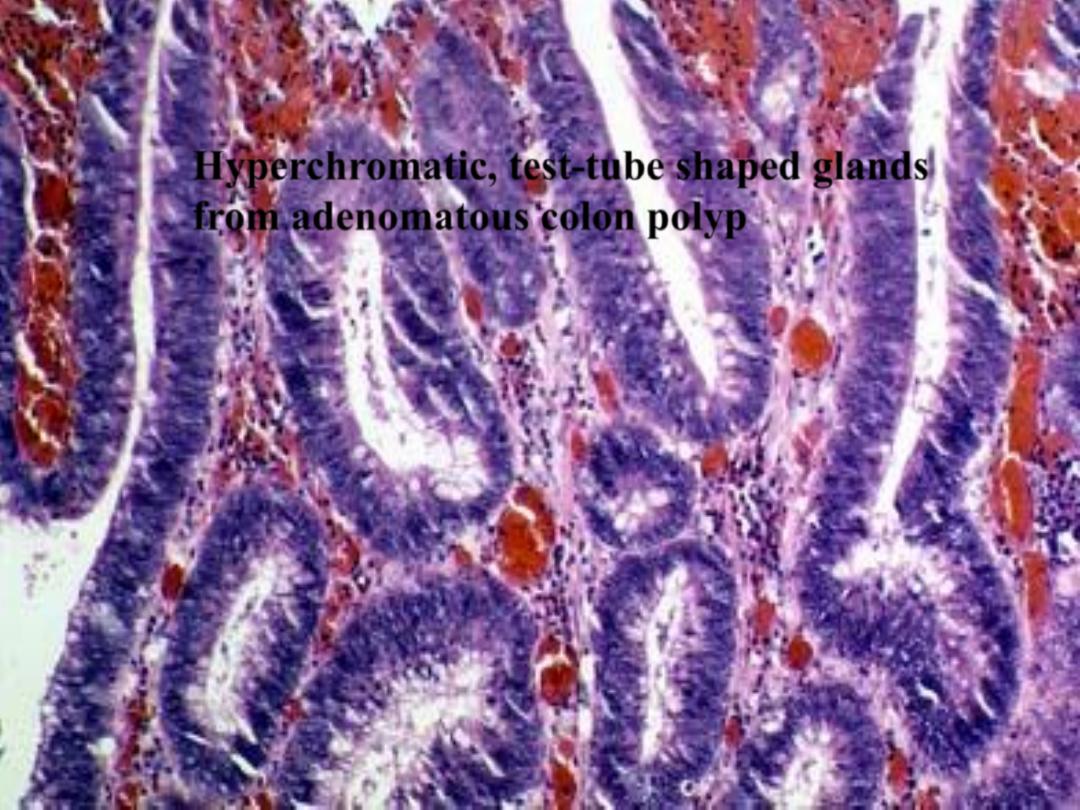
Hyperchromatic, test-tube shaped glands
from adenomatous colon polyp

Colorectal adenocarcinoma
• Majority of ca. in large bowel 98%.
• Both genetic, hereditary & environmental
causes.
• Increasing age &inflammatory bowel
disease.
• Dietary causes.
• Adenoma predispose to ca colon.
NSAID have protective effects.

Colon Adenocarcinoma
• Right colon:
– increasing incidence, especially in elderly
– usually polypoid
– present with bleeding, anemia
• Left colon:
– annular, napkin ring lesions
– present with decreased stool caliber, obstruction
Less than half of cancers are detectable by
proctoscopic exam
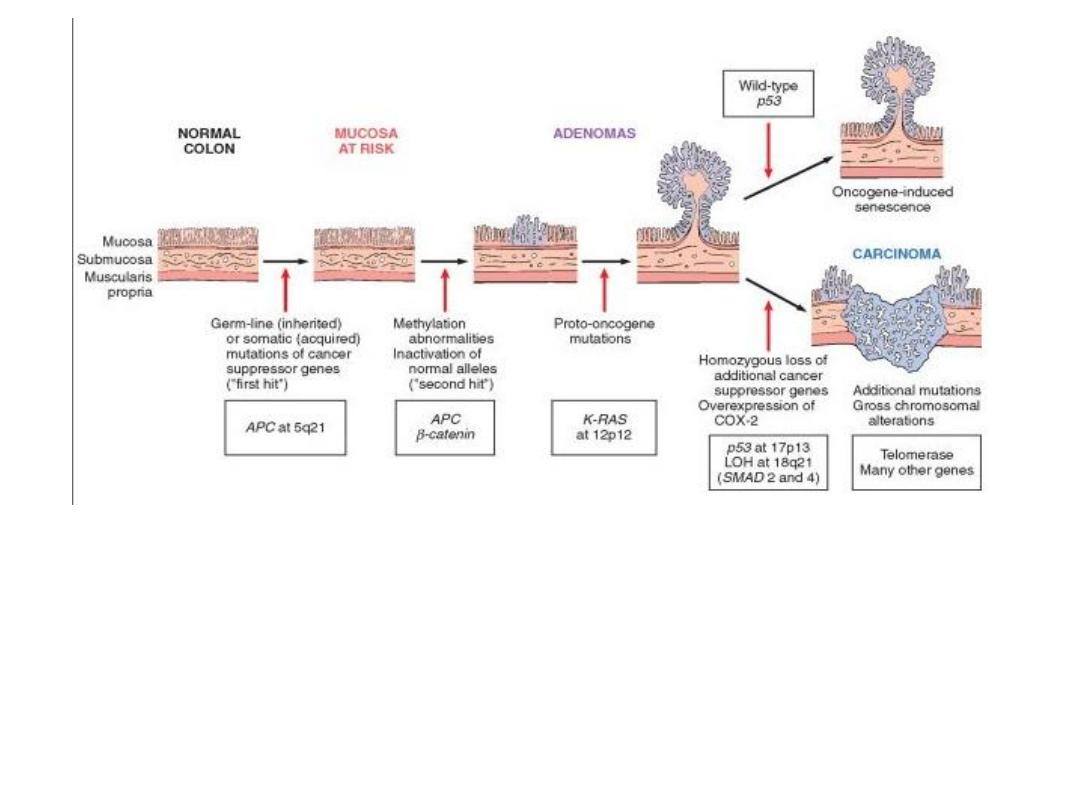
Molecular model for the evolution of colorectal cancers through the
adenoma-carcinoma sequence.
Although
APC
mutation is an early event and loss of
p53
occurs late in the
process of tumorigenesis, the timing for the other changes may be variable.
Note: individual tumors may not have all of the changes listed.
Top right
, cells that gain oncogene signaling without loss of p53 eventually
enter oncogene-induced senescence

Function
Type
Locus
Gene
Regulate intracellular
b-catenin levels Proliferation/
apoptosis/cell
adhesion
Gate keeper
Tumor
suppressor
5q
APC
Membrane associated
G protein
Growth factor signal
transduction
Oncogene
12P
K RAS
TGF-b signaling
pathway
Growth inhibition
signal transduction
Tumor
suppressor
18q
SMAD 2,4
Cell interactions/
adhesion
Apoptosis
Tumor
suppressor
18q
DCC
Cell cycle checkpoint
Apoptosis
Tumor
suppressor
17p
P53

Morphology of colonic adenocarcinoma:
Gross:
Site: 25% in the cecum &ascending colon, 25% in
the descending colon and proximal sigmoid,
the remaining scattered elsewhere.
1. Polypoid growth in the proximal.
2. Annual encirculing lesion in distal colon.
Microscopically:

Hereditary Colon Cancer Sy.
• Familial Adenomatous Polyposis
– autosomal dominant
– mutation in APC gene on 5q21
– 100-2500 polyps throughout GI tract
– virtually 100% risk of carcinoma
• HNPCC (Lynch Syndrome)
– autosomal dominant
– increased risk of GI and non-GI cancers
– lower numbers of polyps than FAP
Hereditary Syndromes Involving the Gastrointestinal Tract
Pathology in GI Tract
Altered Gene
Syndromes
Multiple adenomatous
polyps
APC
Familial adenomatous polyposis (FAP)
• Classic FAP
• Attenuated FAP
• Gardner syndrome
• Turcot syndrome
Hamartomatous polyps
STK11
Peutz-Jeghers syndrome
Juvenile polyps
SMAD4
Juvenile polyposis syndrome
BMPRIA
Colon cancer
Defects in mismatch DNA repair
genes
Hereditary nonpolyposis colorectal
carcinoma
Inflammatory polyps
TSC1
Tuberous sclerosis
TSC2
Hamartomatous polyps
PTEN
Cowden disease
Familial Adenomatous Polyposis
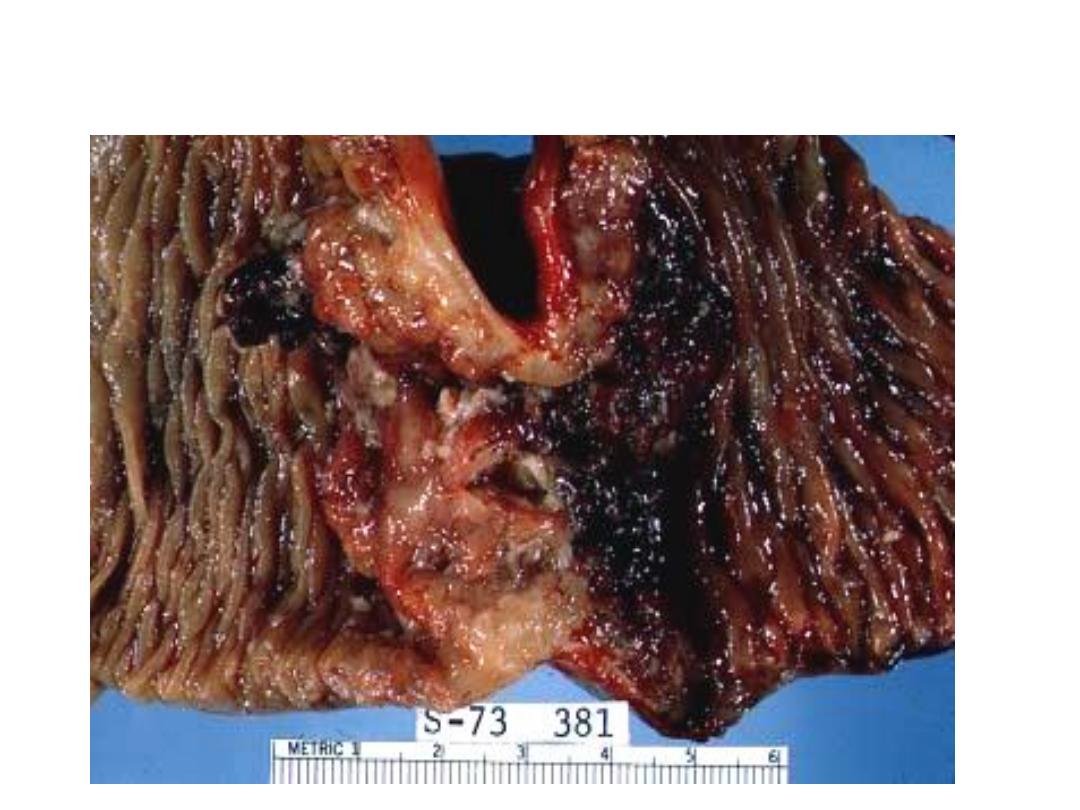
Constricting “napkin ring” Ca
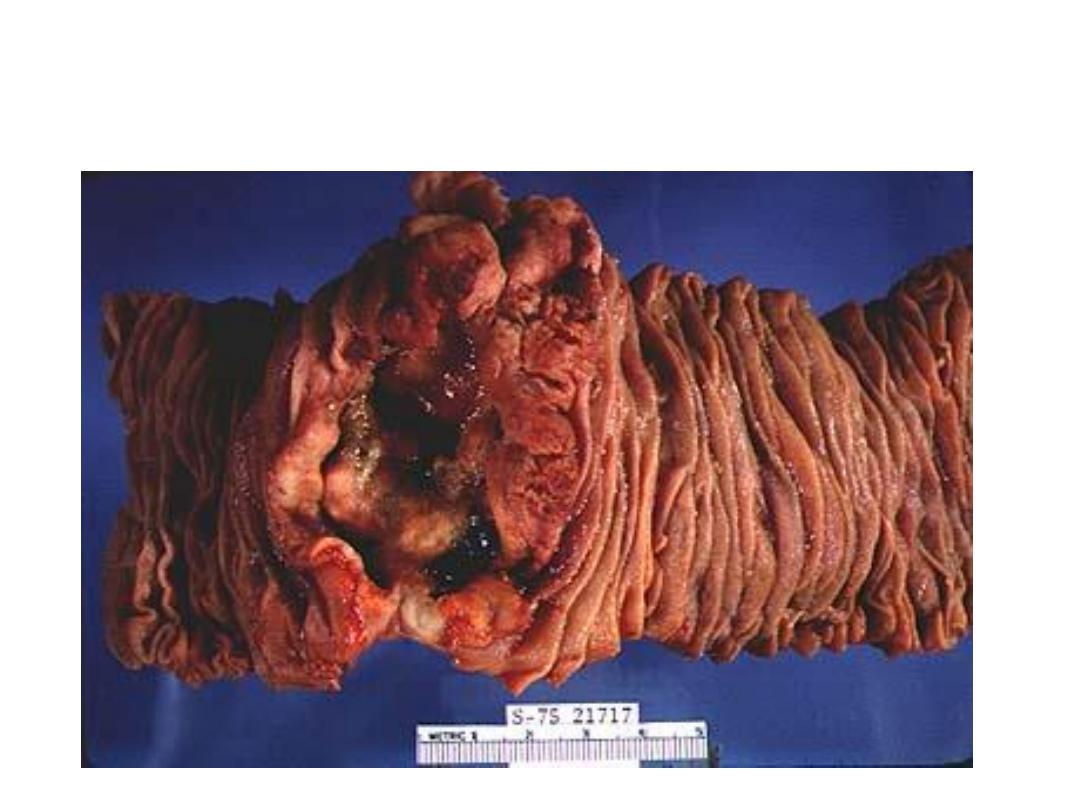
Large Fungating Ca Colon:
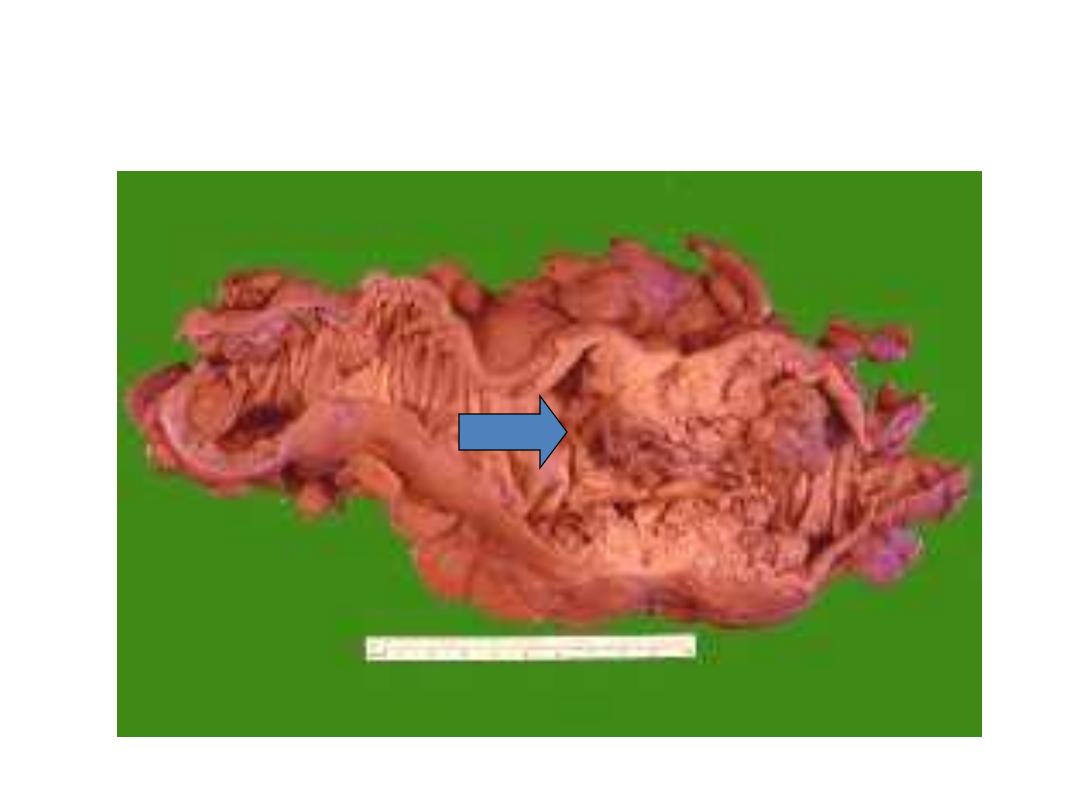
Carcinoma Colon
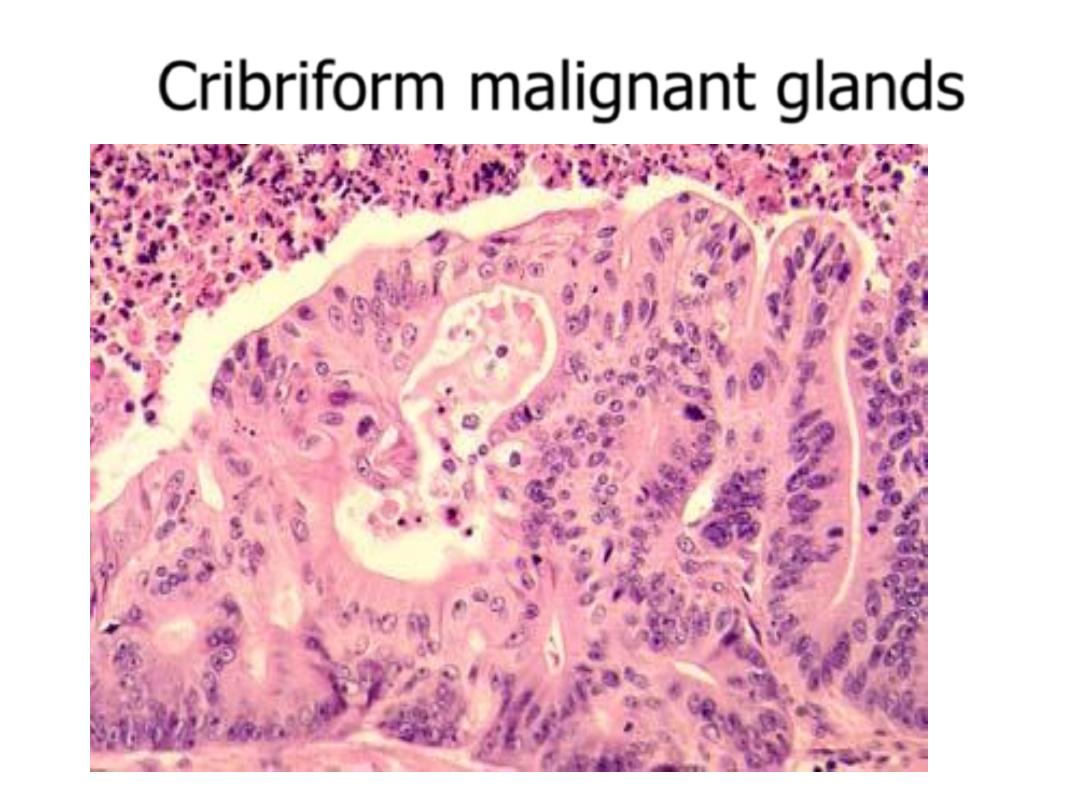
Cribriform malignant glands
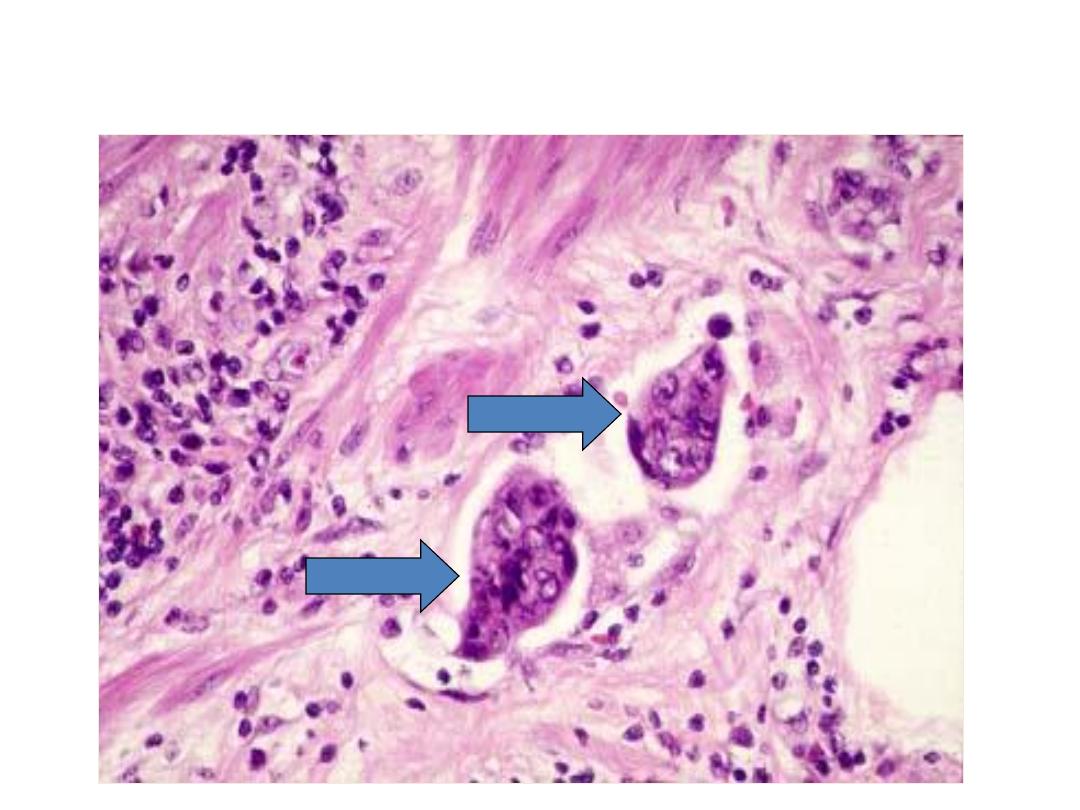
Lymphatic invasion

Tumors of the Anal Canal
The anal canal can be divided into thirds. The upper zone is
lined by columnar rectal epithelium; the middle third by
transitional epithelium; and the lower third by stratified
squamous epithelium. Carcinomas of the anal canal may have
typical glandular or squamous patterns of differentiation,
recapitulating the normal epithelium of the upper and lower
thirds, respectively. An additional differentiation pattern,
termed
basaloid
, is present in tumors populated by immature
cells derived from the basal layer of transitional epithelium.
When the entire tumor displays a basaloid pattern, the archaic
term
cloacogenic carcinoma
is still often applied.
Basaloid differentiation may be mixed with squamous or
mucinous differentiation. All are considered variants of anal
canal carcinoma. Pure squamous cell carcinoma of the anal
canal is frequently associated with HPV infection, which also
causes precursor lesions such as
condyloma accuminatum.

Carcinoid Tumors-pathology
• Solitary or multicentric firm, yellow-tan nodules
• Usually submucosal masses, sometimes with
ulceration
• Cause striking desmoplastic response
• Form islands, trabeculae, glands, or sheets
• Monotonous, speckled nuclei and abundant pink
cytoplasm
• Contain cytoplasmic secretory dense-core granules
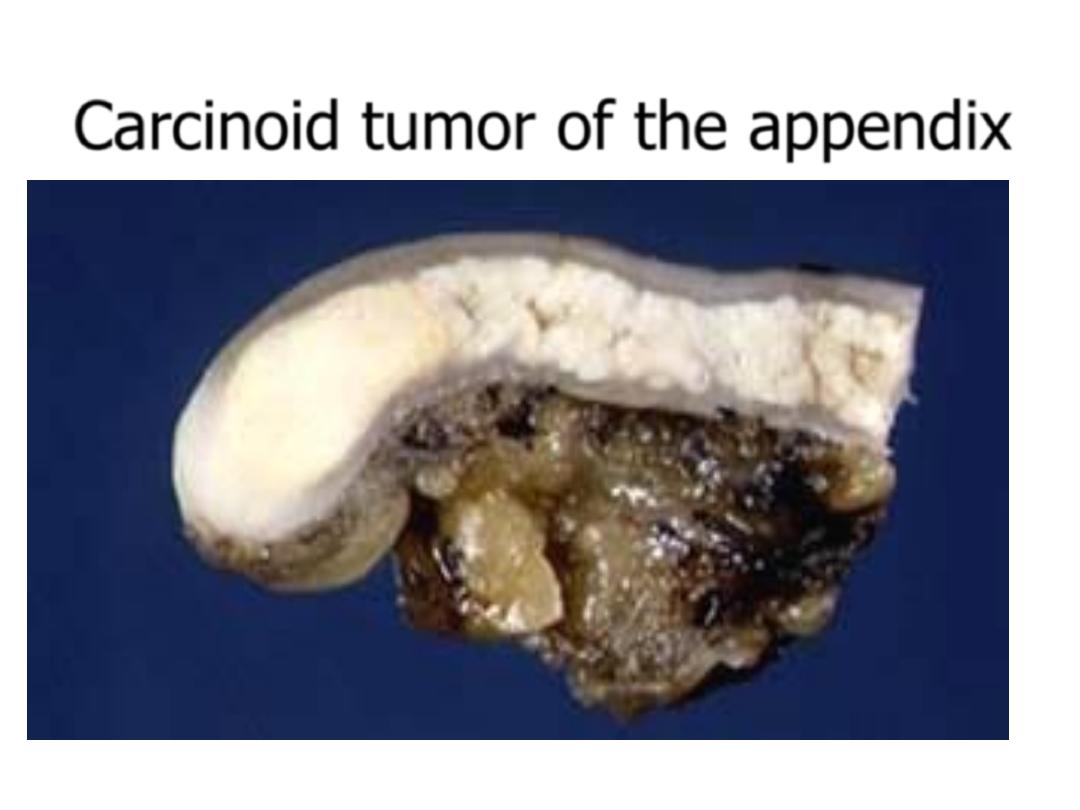
Carcinoid tumor of the appendix
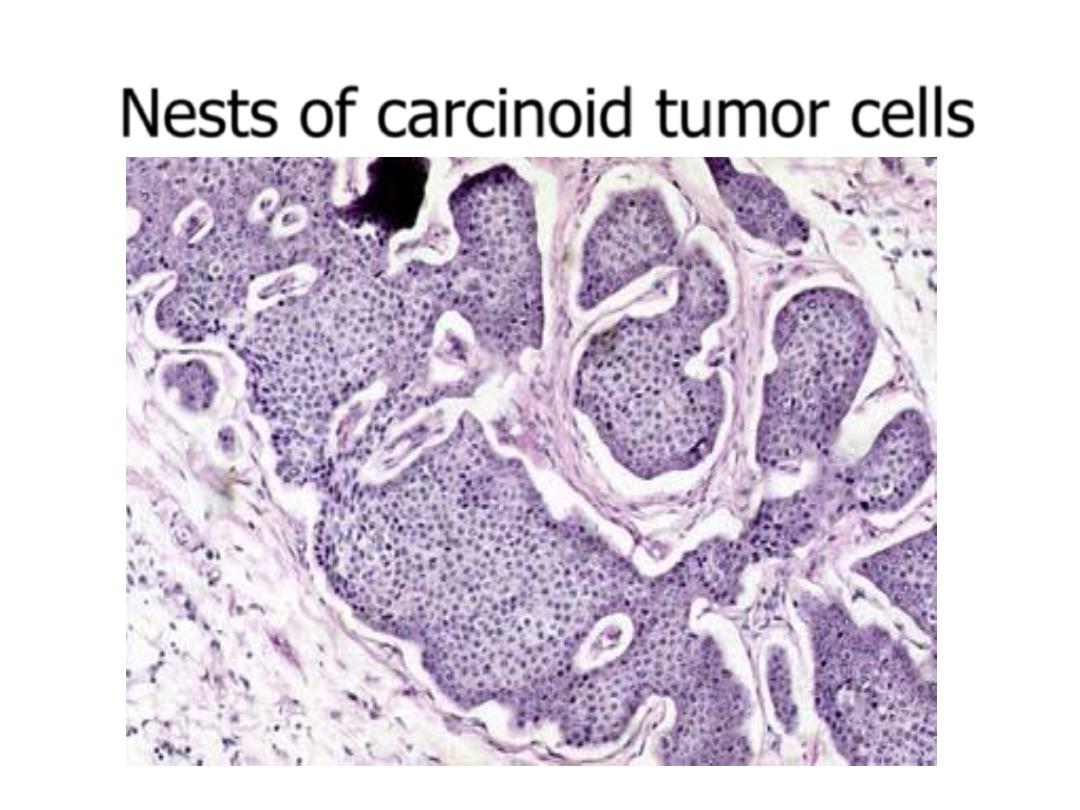
Nests of carcinoid tumor cells

Gastrointestinal Lymphoma
• Most common primary extranodal lymphoma
location
• Sporadic/Western type-most common.
• Thought to arise from Mucosal Associated
Lymphoid Tissues
• Controversial relationship with H. pylori
• T-cell lymphomas associated with celiac sprue
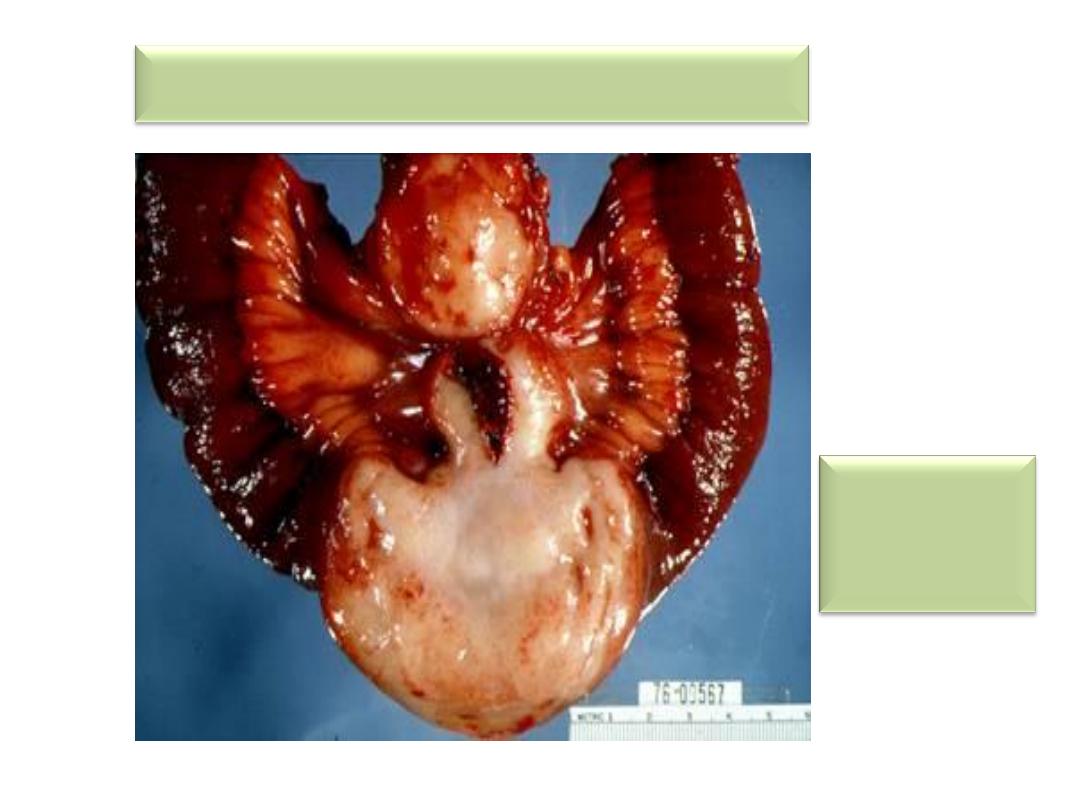
Intestinal B-cell lymphoma
Fleshy
Lymphatic
tumor
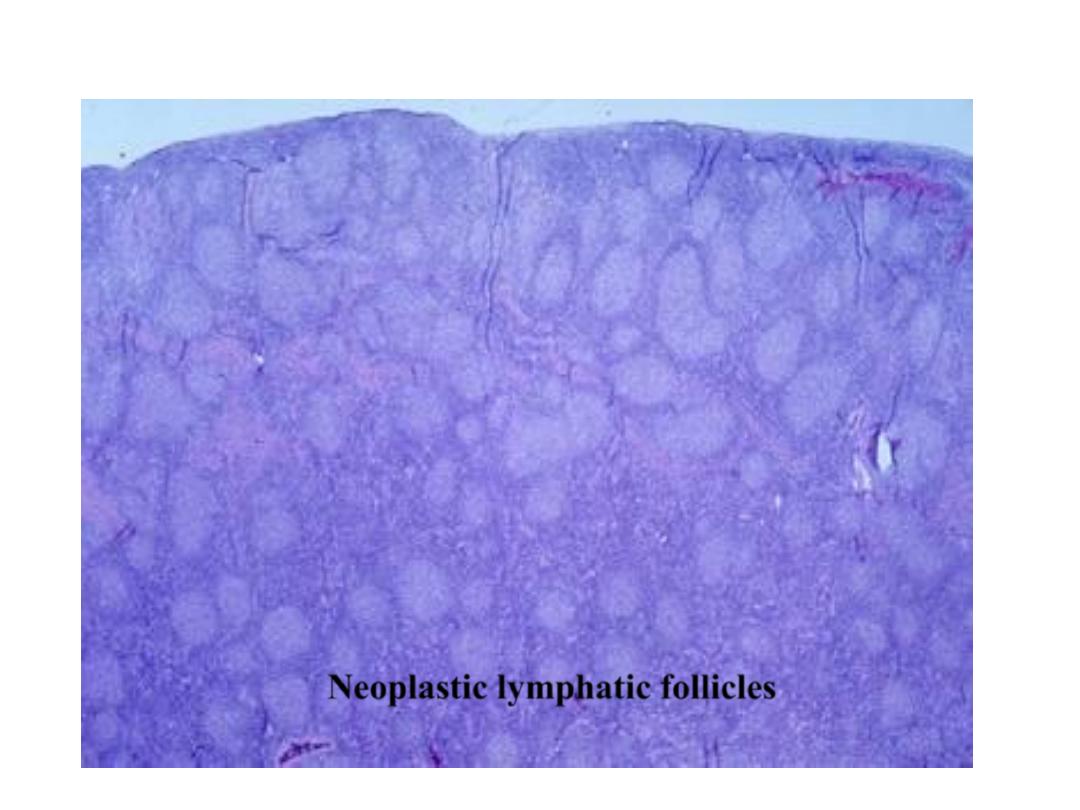
Neoplastic lymphatic follicles

• GIST
• Approximately 75% to 80% of all GISTs have oncogenic,
gain-of-function mutations of the gene encoding the
tyrosine kinase c-KIT, which is the receptor for stem cell
factor. Another 8% of GISTs have mutations that activate a
related tyrosine kinase, platelet-derived growth factor
receptor A (PDGFRA); thus activating mutations in
tyrosine kinases are found in virtually all GISTs. However,
either mutation is sufficient for tumorigenesis, and c-KIT
and PDGFRA mutations are almost never found in a single
tumor.
• GISTs appear to arise from, or share a common stem cell
with, the interstitial cells of Cajal, which express c-KIT, are
located in the muscularis propria, and serve as
pacemaker cells for gut peristalsis.

• MORPHOLOGY
• Primary gastric GISTs usually form a solitary, well
circumscribed,
• fleshy, submucosal mass. Metastases may form
multiple small serosal nodules or fewer large
nodules in the liver; spread outside of the
abdomen is uncommon.
• GISTs can be composed of thin, elongated spindle
cells or plumper epithelioid cells. The most
useful diagnostic marker is c-KIT, consistent with
the relationship between GISTs and interstitial
cells of Cajal, which is immunohistochemically
detectable in 95% of these tumors.

Clinical Features
• Symptoms of GISTs at presentation may be
related to mass effects or mucosal ulceration.
Complete surgical resection is the primary
treatment for localized gastric GIST.
• The prognosis correlates with tumor size, mitotic
index, and location, with gastric GISTs being
somewhat less aggressive than those arising in
the small intestine. Recurrence or metastasis is
rare for gastric GISTs less than 5 cm across but
common for mitotically active tumors larger than
10 cm.
