
1
Chemical Bonds
Prof.Dr. Amer A. Taqa
2017-2018
Atom – the smallest unit of matter “indivisible”
Helium atom
electron shells
a) Atomic number = number of Electrons
b) Electrons vary in the amount of energy they possess, and
they occur at certain energy levels or electron shells.
c)Electron shells determine how an atom behaves when it
encounters other atoms
Electrons are placed in shells according to rules:
1) The 1st shell can hold up to two electrons, and each shell
thereafter can hold up to 8 electrons.
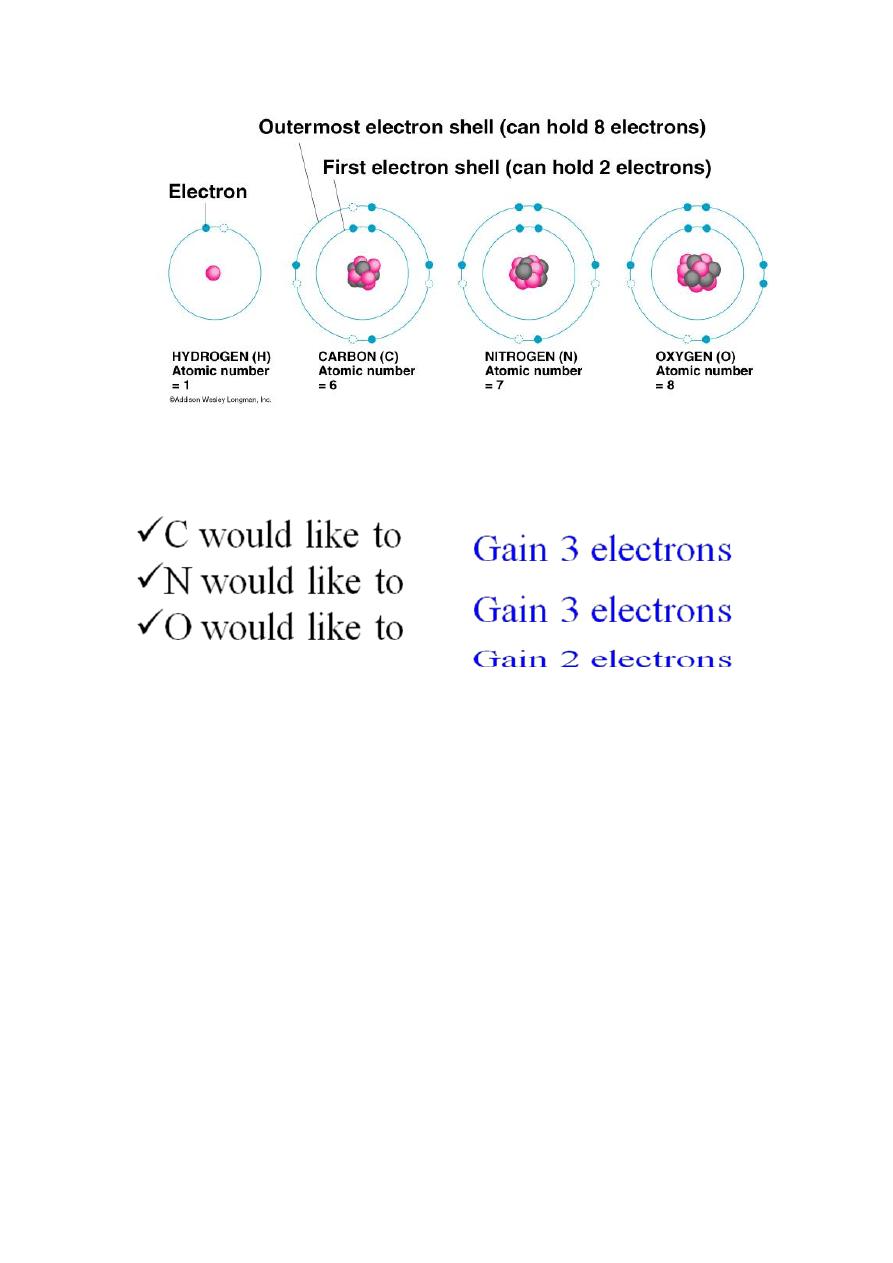
Octet Rule = atoms tend to gain, lose or share electrons so as to
have 8 electrons
Why are electrons important?
1) Elements have different electron configurations
different electron configurations mean different levels of bonding

Lewis structures
Lewis Structure: Representation of a molecule that
shows how the valence electrons are arranged among
the atoms in the molecule.
Bonding involves the valence electrons of atoms.
Example: Na● H-H
Lewis structures of elements
• Dots around elemental symbol

– Symbolize valence electrons
• Thus, one must know valence electron
configuration
Electron Dot Structures
Symbols of atoms with dots to represent the valence-
shell electrons
1 2 13 14 15 16 17 18
H
He:
Li
Be
B
C
N
O
: F
:Ne :

Na
Mg
Al
Si
P
S
:Cl
:Ar :
Chemical bonds: an attempt to fill electron shells
1. Ionic bonds –
2. Covalent bonds –
3. Metallic bonds
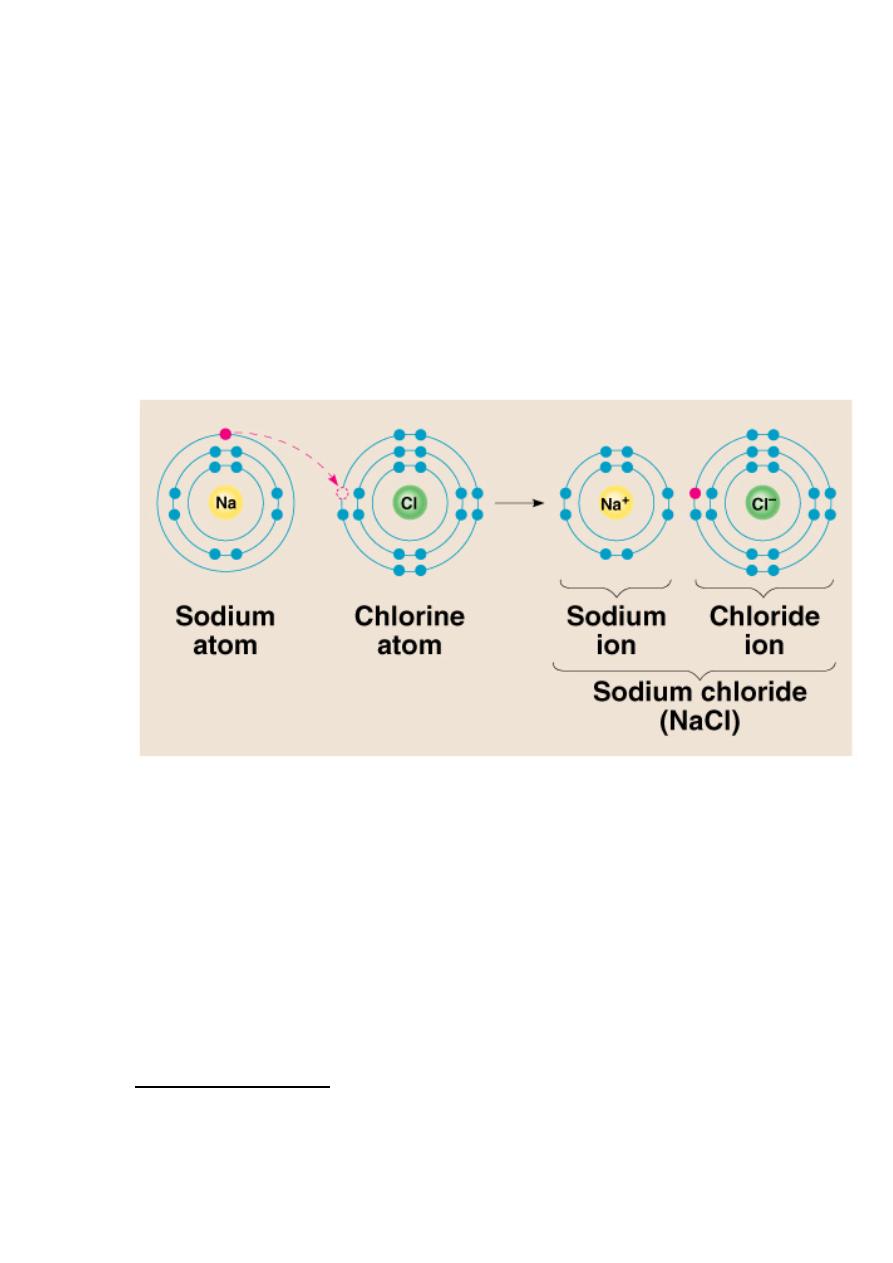
IONIC BOND
bond formed between two ions by the transfer of electrons
Formation of Ions from Metals
Ionic compounds result when metals react with
nonmetals
Metals lose electrons to match the number of
valence electrons of their nearest noble gas
Positive ions form when the number of electrons
are less than the number of protons
Group 1 metals
ion
1+
Group 2 metals
ion
2+
•
Group 13 metals
ion
3+
Formation of Sodium Ion
Sodium atom Sodium ion

Na
– e
Na
+
2-8-1
2-8 ( = Ne)
11 p
+
11 p
+
11 e
-
10 e
-
0 1
+
Formation of Magnesium Ion
Some Typical Ions with Positive Charges (Cations)
Group 1
Group 2
Group 13
H
+
Mg
2+
Al
3+
Li
+
Ca
2+
Na
+
Sr
2+
K
+
Ba
2+

Ions from Nonmetal Ions
In ionic compounds, nonmetals in 15, 16, and 17 gain electrons
from metals
Nonmetal add electrons to achieve the octet arrangement
Nonmetal ionic charge:
3-, 2-, or 1-
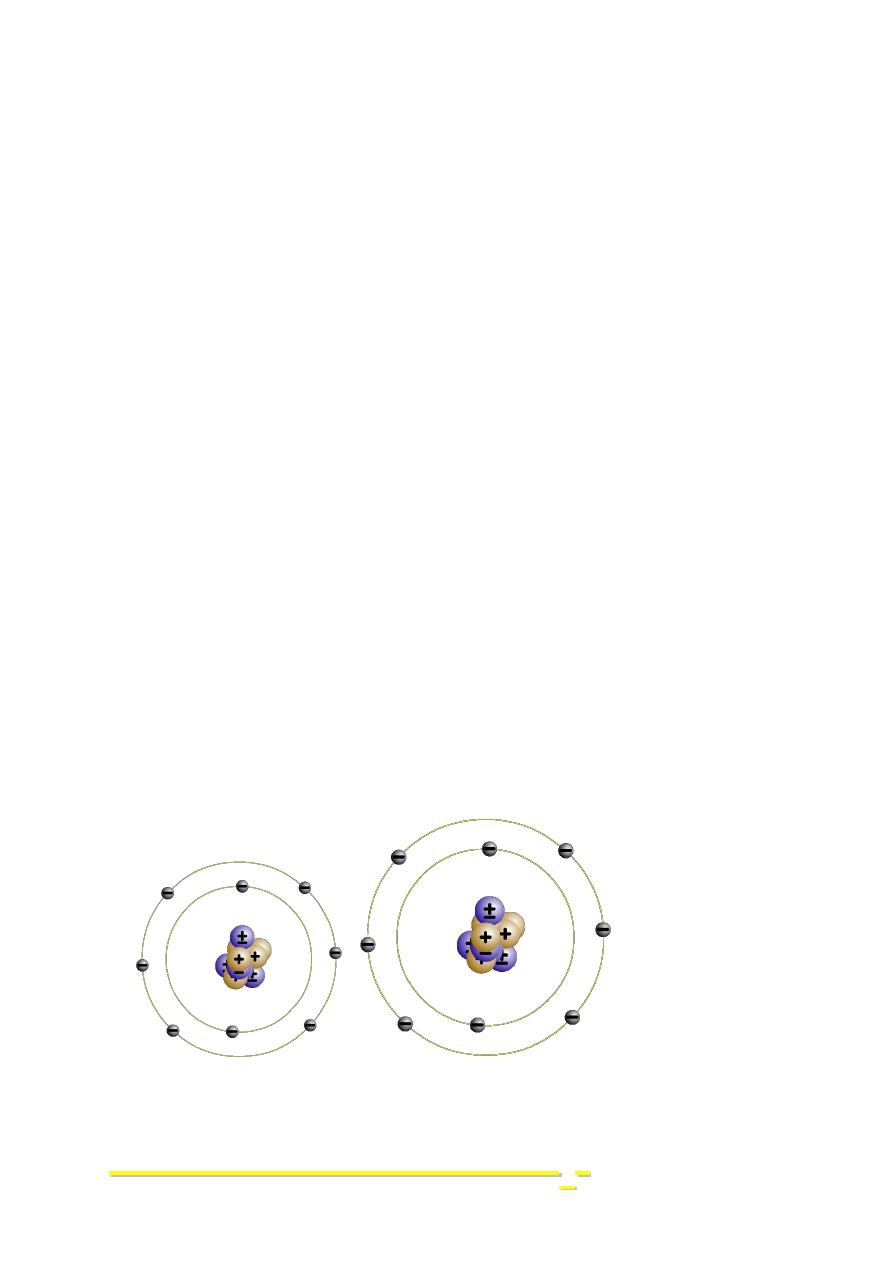
Fluoride Ion
Ionic Bond
unpaired electron
octet
1 -
:
F
+ e
:
F
:
2-7
2-8
(= Ne)
9 p+
9 p
+
9 e-
10 e-
0
1 -
ionic charge
• Between atoms of metals and nonmetals with very
different electronegativity
• Bond formed by transfer of electrons
• Produce charged ions all states. Conductors and
have high melting point.
• Examples; NaCl, CaCl
2
, K
2
O
Ionic bond – electron from Na is transferred to Cl, this
causes a charge imbalance in each atom. The Na
becomes (Na+) and the Cl becomes (Cl-), charged
particles or ions
COVALENT BOND
bond formed by the sharing of electrons
• Between nonmetallic elements of similar
electronegativity.
• Formed by sharing electron pairs
• Stable non-ionizing particles, they are not
conductors at any state
• Examples; O
2
, CO
2
, C
2
H
6
, H
2
O, SiC
• Bonds in all the polyatomic ions and diatomics are
all covalent bonds
• NONPOLAR
COVALENT BONDS
when electrons are shared equally
H
2
or Cl
2
2. Covalent bonds- Two atoms share one or more pairs
of outer-shell electrons.
O
O
x
x
y
y
g
g
e
e
n
n
A
A
t
t
o
o
m
m
O
O
x
x
y
y
g
g
e
e
n
n
A
A
t
t
o
o
m
m

POLAR COVALENT BONDS
O
2
H
unequally
when electrons are shared but shared
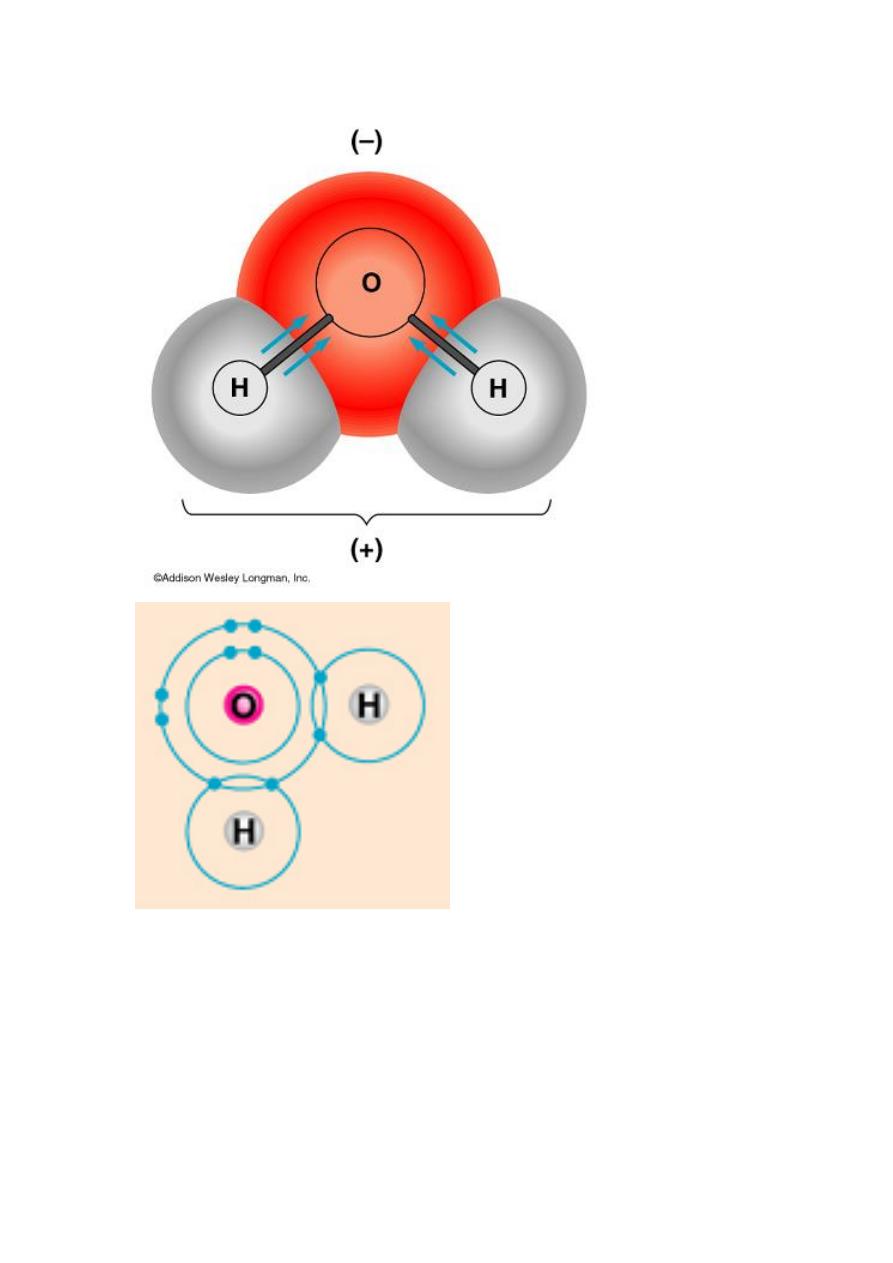
water is a polar molecule because oxygen is more
electronegative than hydrogen, and therefore electrons
are pulled closer to oxygen.

METALLIC BOND
bond found in metals; holds metal atoms together very
strongly
Metallic Bond
• Formed between atoms of metallic elements
• Electron cloud around atoms
• Good conductors at all states, lustrous, very high
melting points
• Examples; Na, Fe, Al, Au, Co
Ionic Bond, A Sea of Electrons
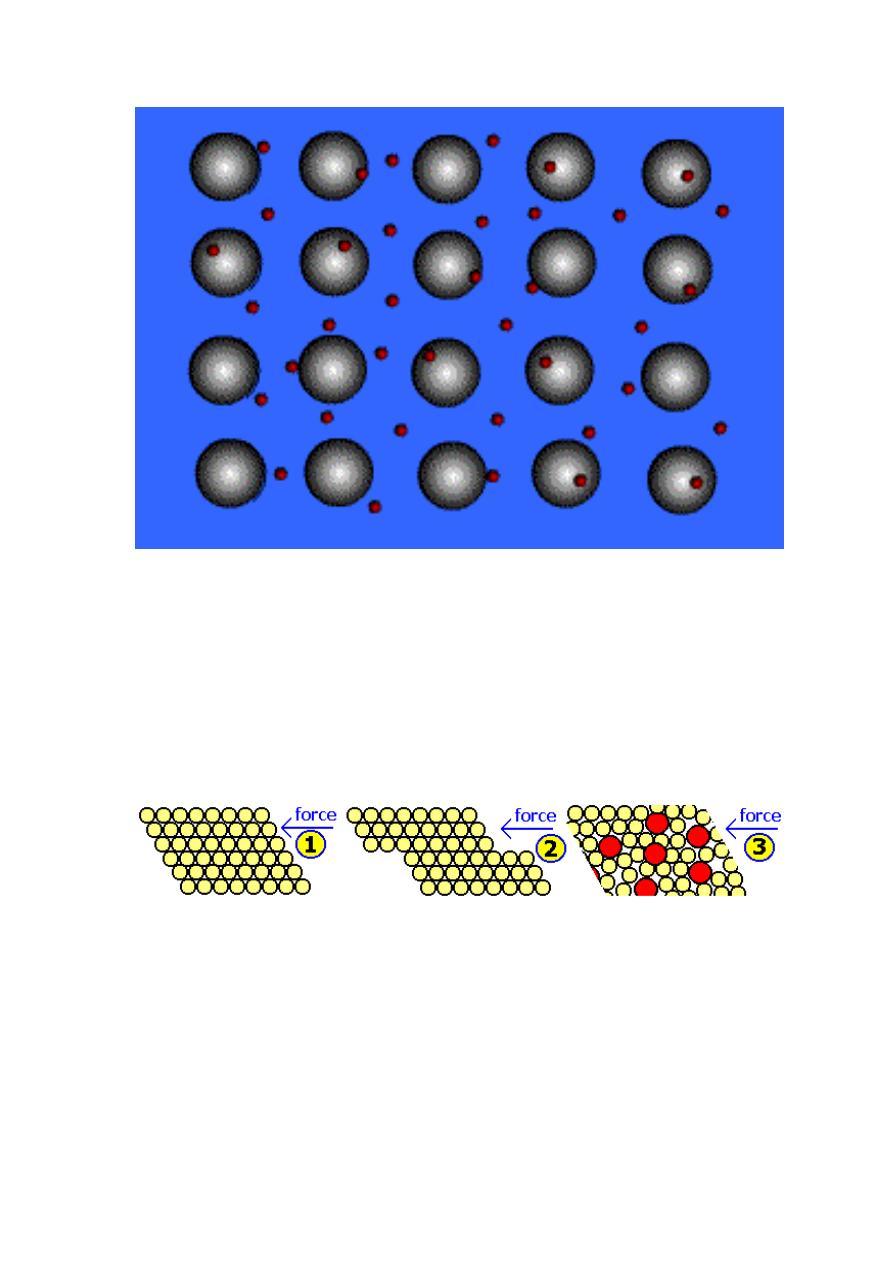
Metals Form Alloys
Metals do not combine with metals. They form Alloys
which is a solution of a metal in a metal.Examples are
steel, brass, bronze and pewter.
Formula Weights
• Formula weight is the sum of the atomic masses.
• Example- CO
2
• Mass, C + O + O

12.011 + 15.994 + 15.994
43.999
Practice
• Compute the mass of the following compounds
round to nearest tenth & state type of bond:
• NaCl;
• 23 + 35 = 58; Ionic Bond
• C
2
H
6
;
• 24 + 6 = 30; Covalent Bond
• Na(CO
3
)
2
;
• 23 + 2(12 + 3x16) = 123; Ionic & Covalent
