
1
Carbohydrates
[CHO]
Chemistry of Carbohydrates
All carbohydrates contain C O &OH-functional groups &
are classified into:
1-Monosaccharides... Simple sugar that can not hydrolyzed to a
simpler form, it may contain three, four, five, six or more carbon
atoms known respectively as trioses, tetroses, pentoses, hexoses
& so on.
Monosaccharides may be aldoses or ketoses depending upon
whether they have an aldehyde or ketone group respectively.
Most important monosaccharides are hexoses like glucose,
galactose & fructose which are reducing substances because it
contains aldehyde or ketone groups.
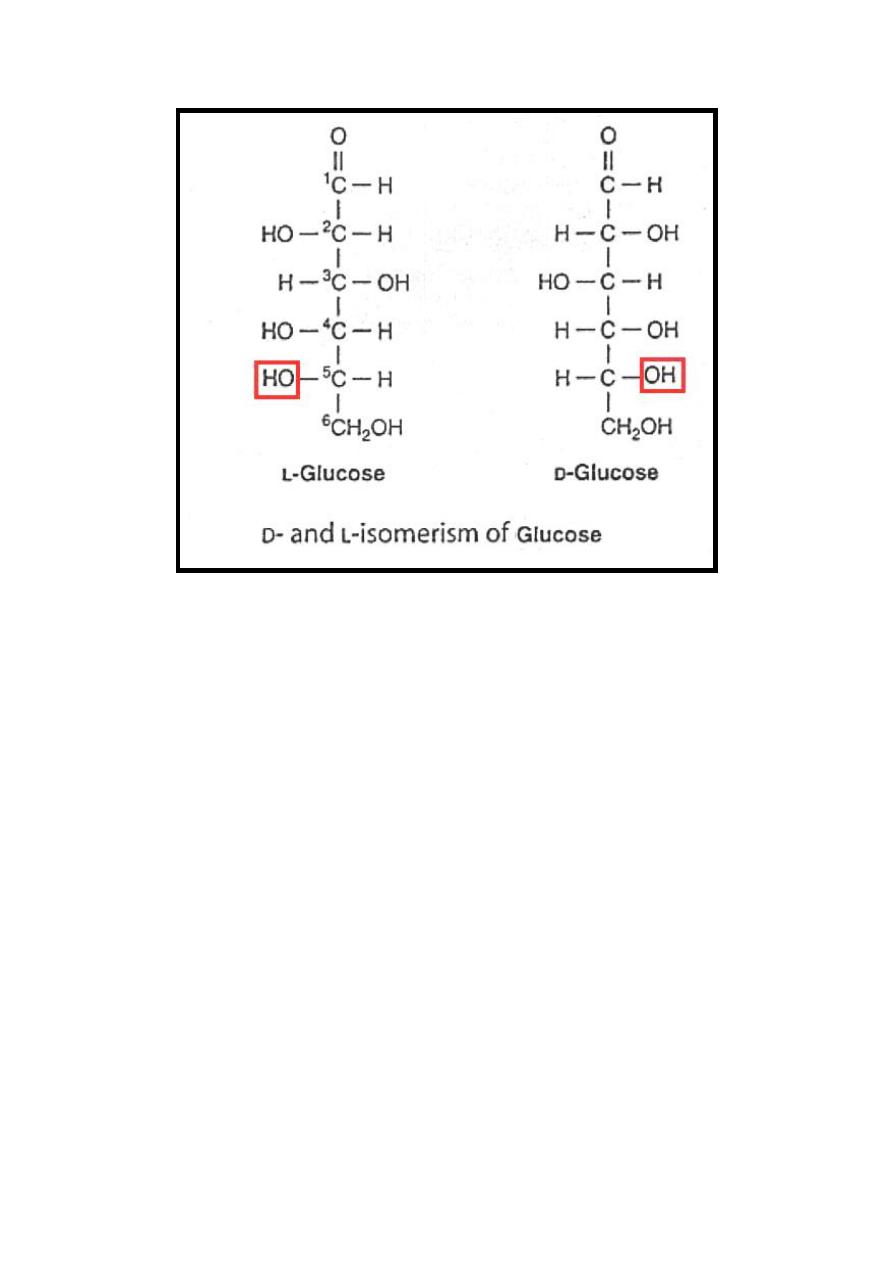
Monosaccharides have stereoisomer property which could be
D (common) or of its mirror image L (D on right & L on left)
depending on position of hydroxyl group at carbon atom
adjacent to the terminal alcohol carbon ((C
5
in glucose))
.
2
2-Disaccharides... They are products of chemical reaction
between two monosaccharides with loss of a molecule of water
(can be hydrolyzed), the linkage between two monosaccharides
known as glycosidic link.
Examples of disaccharides are maltose, lactose & sucrose.
If the glycosidic link between aldehyde or ketone group of one
monosaccharide
&
the
hydroxyl
group
of
another
monosaccharide the produced disaccharide have reducing
property as in maltose (glucose + glucose) & lactose (glucose +
galactose ) while if the glycosidic link between aldehyde or
ketone group of the two molecules of monosaccharide the
produced disaccharide have no reducing property as in sucrose
(glucose + fructose).
3-Oligosaccharides...They are products of condensation of 3-
10 monosaccharide units as in maltotriose.
4-Polysaccharides… They are products of condensation of
more than 10 monosaccharide units; examples are:-

3
A-Starch- Polysaccharide of plant origin consist of amylose
(one unbranched chain of glucose molecules linked by α-1, 4-
glucosidic linkages with only terminal aldehyde is free) &
amylopectin (contain α-1, 4-glucosidic linkages + α-1, 6-
branched glucosidic linkages of glucose molecules).
B-Glycogen-Polysaccharide of animal origin, it has structure
similar to amylopectin except that branching is more extensive.
Fate of Carbohydrates
Carbohydrates account for a large proportion of daily intake,
dietary digestible carbohydrates include mainly starch , sucrose
and to less extent lactose.
In order of carbohydrates to be absorbed it should be converted
to monosaccharides by digestion.
The absorbed monosaccharides (glucose, fructose & galactose)
from small intestine reach the liver through portal vein, glucose
is the only carbohydrate to be directly used for energy or stored
as glycogen while galactose & fructose are mainly converted to
glucose in the liver before they can be used.
Pentoses as xylose, arabinose & ribose are important in
nucleotides, nucleic acids & several coenzymes.
Carbohydrate (mainly glucose) is a main source of human
energy & it is a unique source of energy to some tissues as
nervous system including the brain & in RBC, therefore, we
concern with glucose.
After absorption of glucose it converted to glucose-6 phosphate
inside the cells which may follow one of the following pathways
depending on energy requirement, type of tissue & state of
glycogen storage.
1-Glycolysis… Produce energy.
2-Hexose monophosphate shunt {phosphogluconate oxidative
pathway, pentose phosphate pathway}...Nucleotide synthesis.
3-Glycogenesis... Storage.

4
Glycolysis
Glycolysis is the major pathway for glucose metabolism,
occurs in the cytosol of all cells ((outside the mitochondria))
through Embden-Meyerhof pathway. Its unique in that it can
function either aerobically or anaerobically, however , anaerobic
conditions limit the amount of energy liberated /mole of glucose
, therefore , more glucose are needed..
To oxidize glucose beyond pyruvate (the end product of
glycolysis) requires oxygen, mitochondrial enzyme system
,
the
citric
acid
cycle
&
the
respiratory
chain.
The ability of glycolysis to provide ATP in the anaerobic
conditions are especially important in RBC which lack
mitochondria & completely depend on glucose as their metabolic
fuel,
also
in
skeletal
muscle
in
anoxic
episodes.
However, in heart muscle, which is adapted for aerobic
performance, has relatively low glycolytic activity & poor
survival under conditions of ischemia.
5
The steps of glycolysis ((Embden-Meyerhof pathway)) are the
followings:
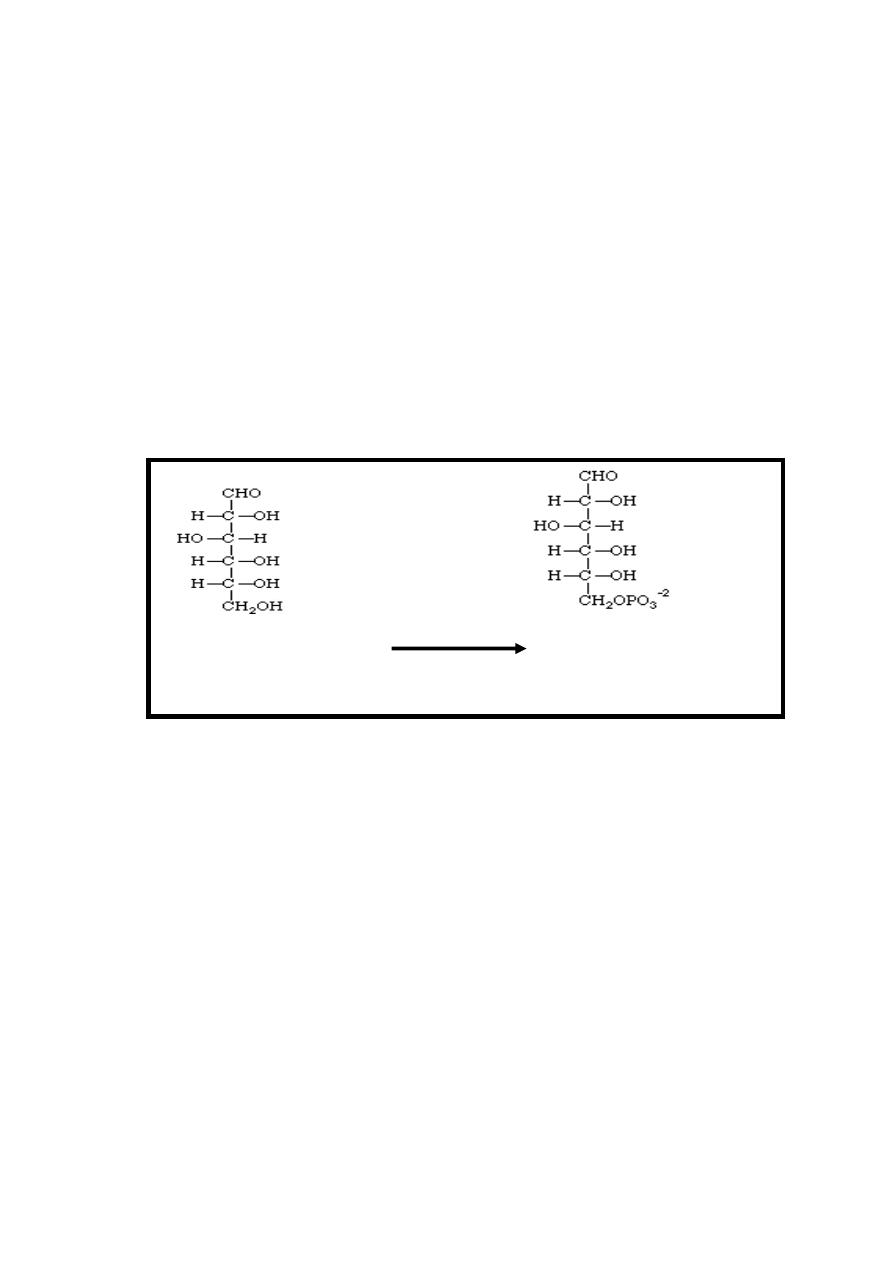
Reaction 1: Phosphate Ester Synthesis
In all body tissues except the liver, brain & pancreatic β islet
cells, the transport of glucose into the cell is regulated by
insulin.
Following entry of glucose into the cells , phosphate is added
to the glucose present in the cytoplasm at the C-6 position using
ATP as the phosphate donor in the presence of magnesium ion,
this reaction is irreversible inhibited by its product ((glucose 6-
phosphate)) & it's catalyzed by the enzymes hexokinase or
glucokinase.
Glucose + ATP
Mg
++
Glucose 6-P+ADP
Hexokinase
Glucokinase
Hexokinase has a high affinity for its substrate (glucose) & its
even act at lower speed on other hexoses, in the liver &
pancreatic β islet cells hexokinase is saturated under all normal
conditions, therefore, both the liver & pancreatic β islet cells
also contain an isoenzyme of hexokinase called glucokinase,
which has lower affinity for its substrate (specific on glucose) so
it acts at a higher glucose concentration.
The function of glucokinase in the liver is to remove glucose
from the blood following a meal, providing glucose 6-phosphate
in excess of requirements for glycolysis, which will be used for
glycogen synthesis and lipogenesis.
In the pancreas, the glucose
6-phosphate formed by
glucokinase signals increased glucose availability & leads to the
secretion of insulin.
6
Glucose 6-phosphate is an important compound at the junction
of several metabolic pathways (glycolysis, gluconeogenesis,
pentose phosphate pathway, glycogenesis & glycogenolysis).
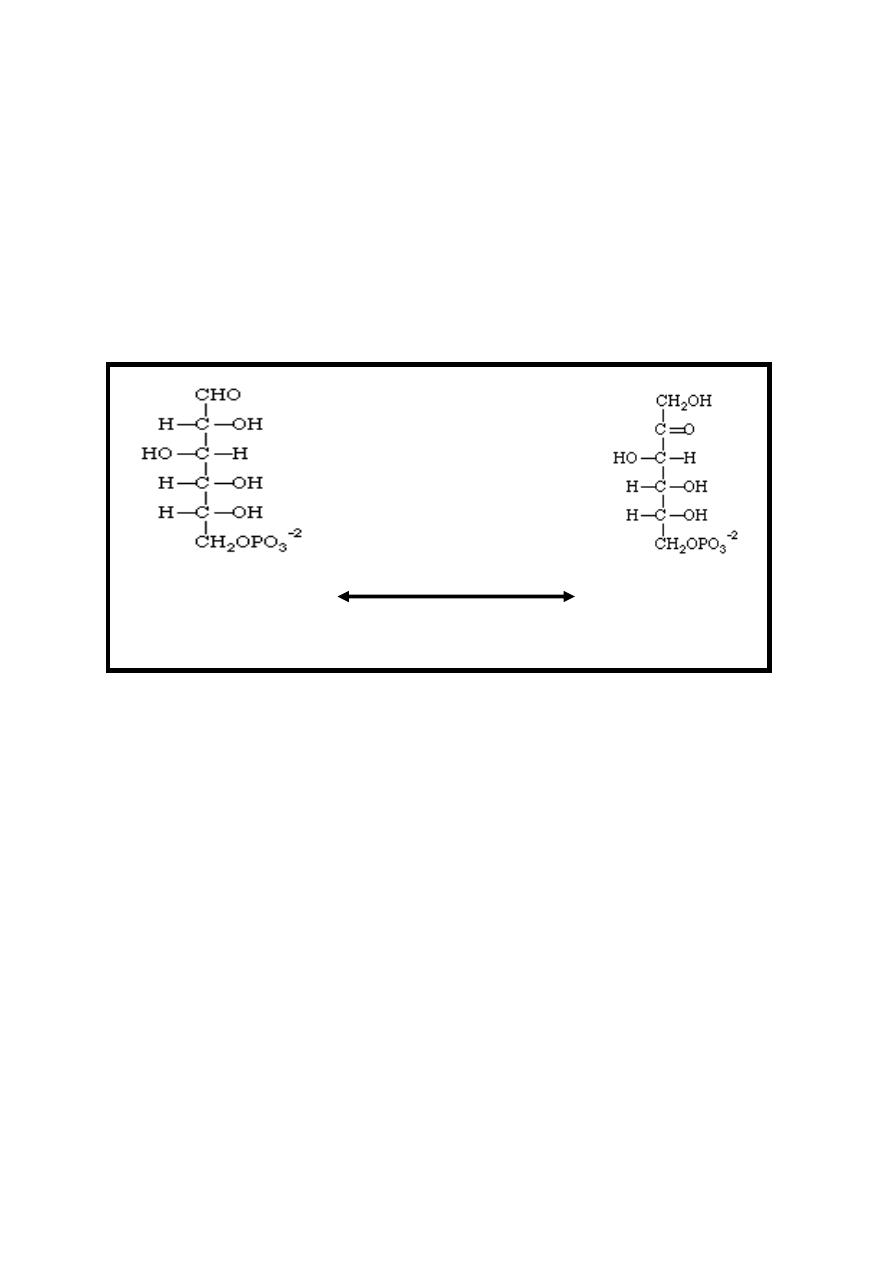
Reaction 2: Isomerization
The glucose-6-phosphate is changed into an isomer, fructose-6-
phosphate. This means that the number of atoms is unchanged,
but their positions have changed (aldose to ketose conversion)
.This reversible reaction is catalyzed by phosphohexose
isomerase (phosphoglucoisomerase) enzyme.
Glucose-6-P Phosphohexose Fructose-6-p
Isomerase
Reaction 3: Phosphate Ester Synthesis
This reaction is virtually identical to reaction 1. The fructose-6-
phosphate is reacted with phosphate from ATP to make
fructose-1, 6 -bisphosphate again this reaction using ATP as the
phosphate donor in the presence of magnesium ion.
This reaction is irreversible, catalyzed by phosphofructokinase
enzyme & it has a major role in regulating the rate of glycolysis.
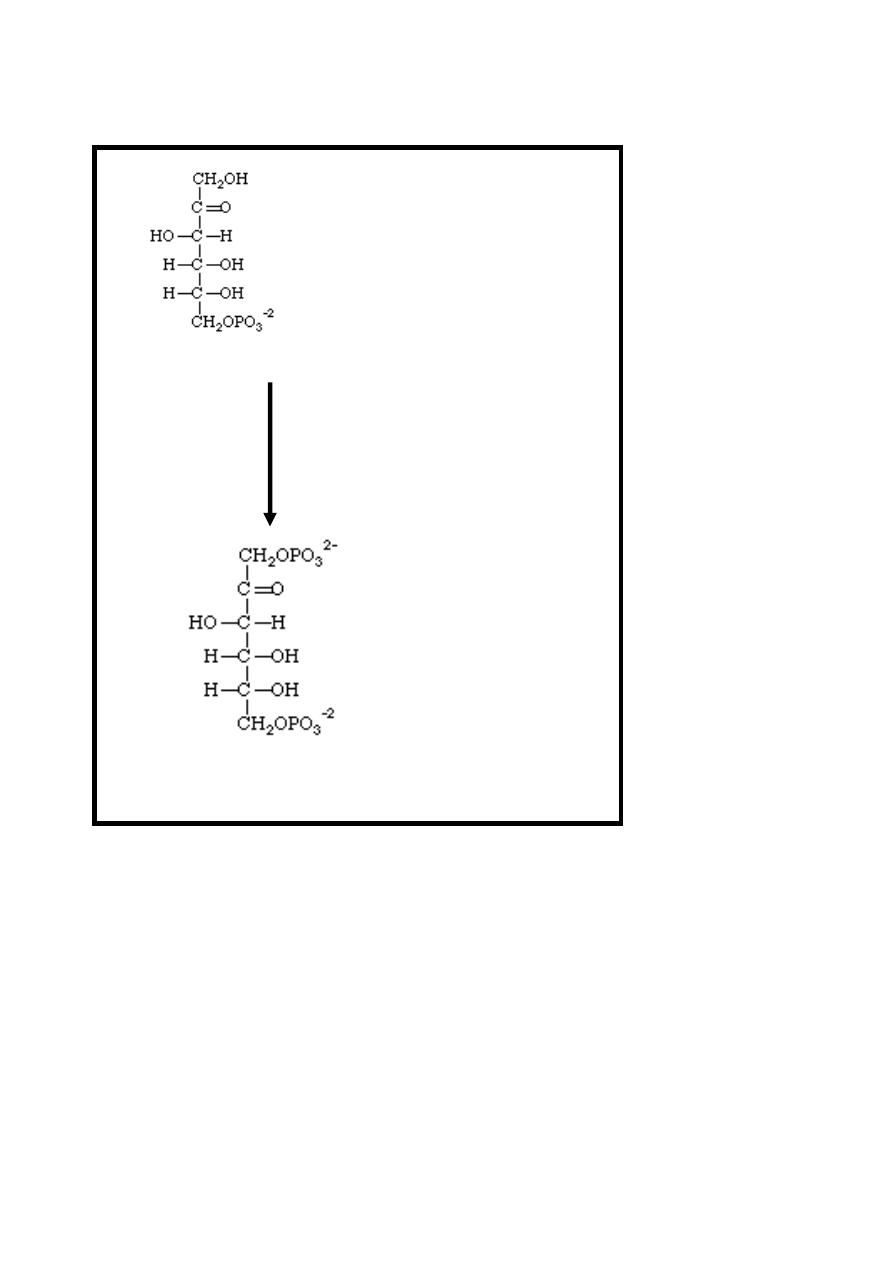
7
Fructose-6-P + ATP
Mg
++
Phosphofructokinase
Fructose-1, 6-bisphosphate + ADP
Reaction 4: Split Molecule in half
The six carbon fructose-1, 6-bisphosphate is split into two
trioses phosphate carbon compounds which are
dihydroxyacetone-phosphate & glyceraldehyde 3-phosphate
.The slit is made between the C-3 and C-4 of the fructose. This
reversible reaction is catalyzed by Aldolase enzyme.
The dihydroxyacetone phosphate & glyceraldehyde-3-phosphate
are interconverted by the enzyme phosphotriose
isomerase.
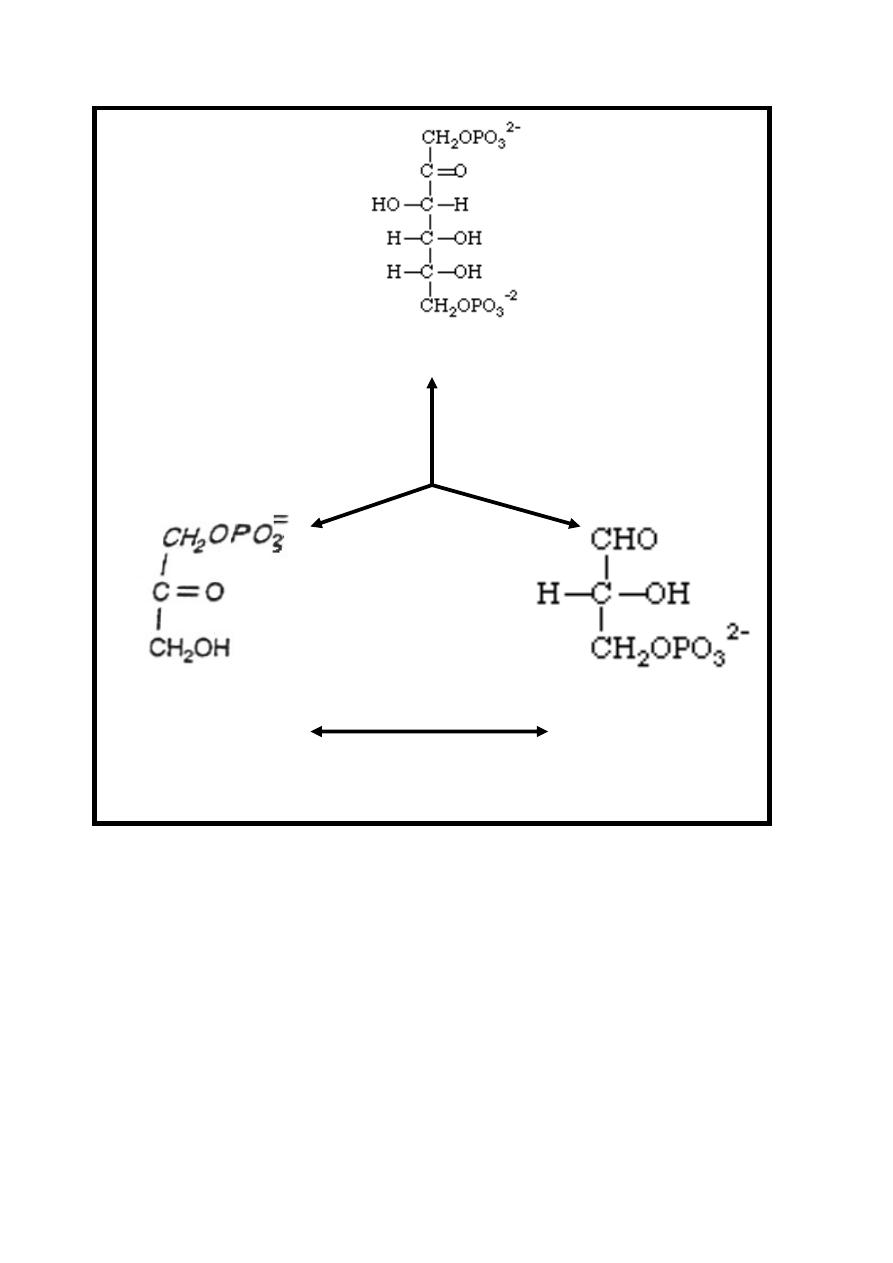
8
Fructose-1, 6-bisphosphate
Aldolase
Dihydroxyacetone- Glyceraldehyde
phosphate 3-phosphate
Phosphotriose
Isomerase
Reaction 5: Oxidation/Phosphate Ester Synthesis
This reversible reaction is first an oxidation involving the
coenzyme NAD
+
. Glyceraldehyde 3-phosphate is oxidized to an
acid as an intermediate through the conversion of NAD
+
to
NADH + H
+
. Then an inorganic phosphate (Pi) is added in a
phosphate ester synthesis to form 1, 3-bisphosphoglycerate.
This and all the remaining reactions occur twice for each
glucose-6-phosphate (six carbons), since there are now two
molecules of 3-carbons each.
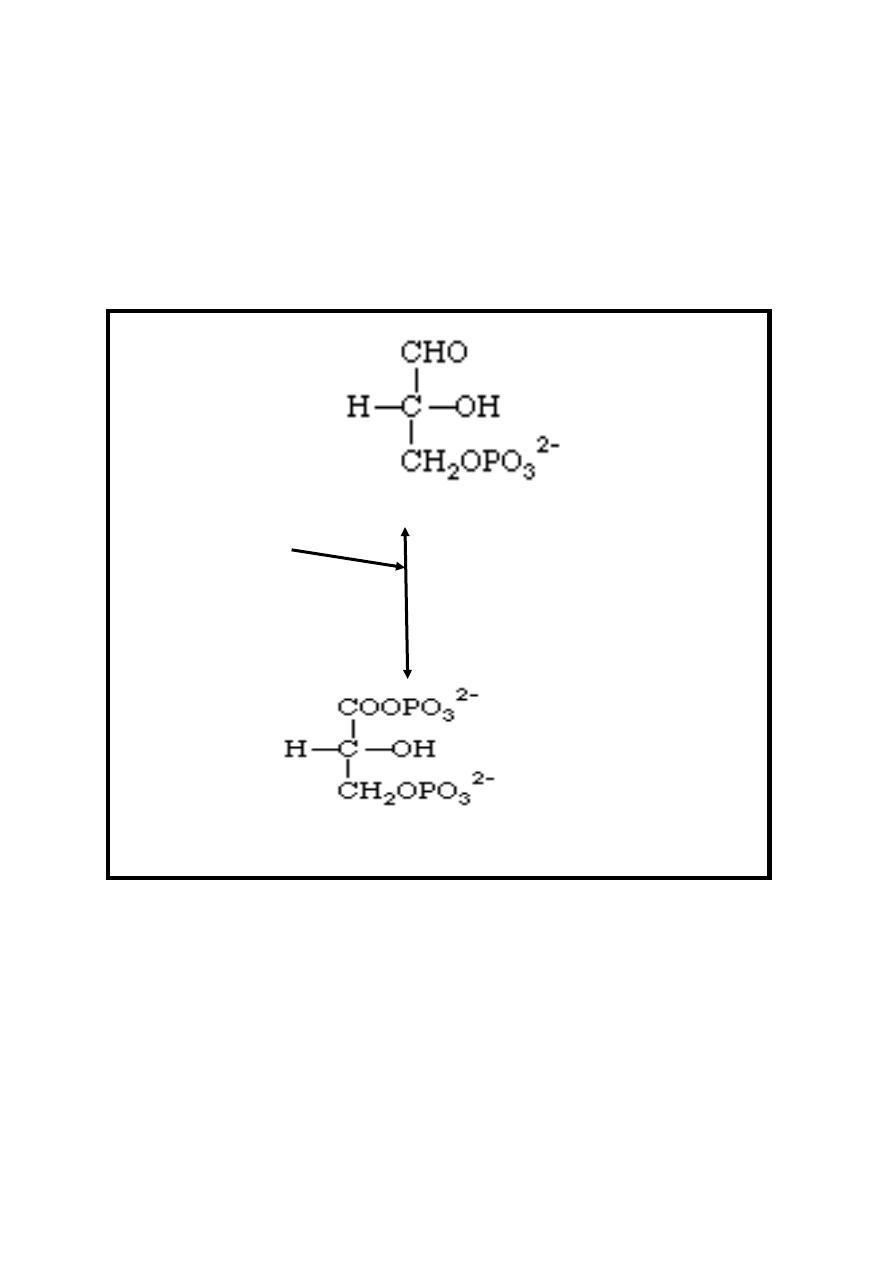
9
This reaction is catalyzed by glyceraldehyde-3-phosphate
dehydrogenase enzyme which is a tetramer (consist of four
monomers) containing SH-groups , therefore , this
dehydrogenase enzyme may be inactivated by SH poison
iodoacetate which stop glycolysis at this point , therefore ,
iodoacetate used as a preservative of blood sample to prevent in
vitro glycolysis .
Glyceraldehyde 3-phosphate +NAD
+
Pi Glyceraldehyde-3-
phosphate dehydrogenase
1, 3-bisphosphoglycerate+ NADH + H
+
Reaction 6: Hydrolysis of Phosphate; Synthesis of ATP
One of the phosphate groups of 1, 3-bisphosphoglycerate
undergoes hydrolysis to form 3-phosphoglycerate and a
phosphate ion is transferred directly to an ADP to make ATP,
therefore, at this stage two molecules of ATP are produced /
molecule of glucose undergo glycolysis, this reversible reaction
is catalyzed by Phosphoglycerate kinase enzyme in the
presence of magnesium ion.
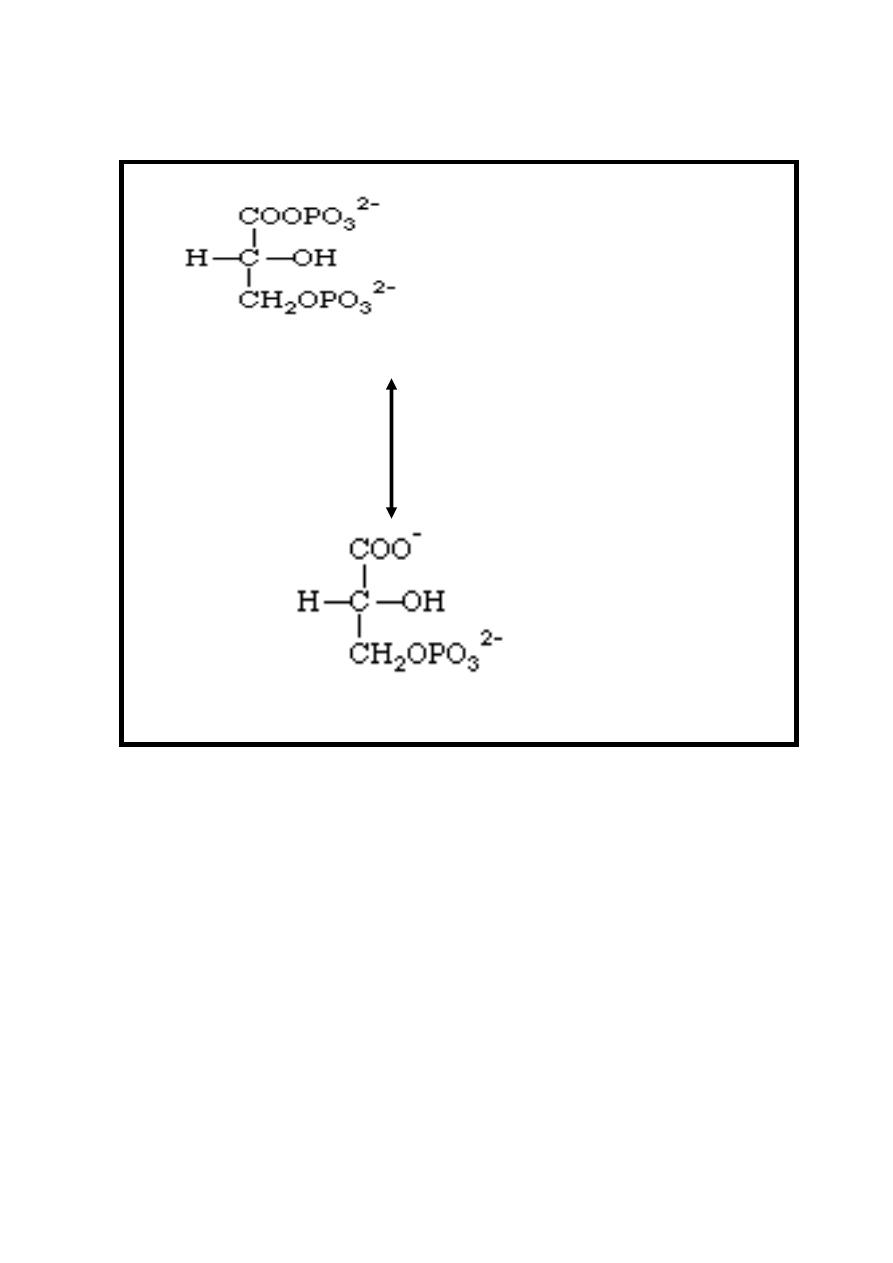
10
1, 3-bisphosphoglycerate + ADP
Mg
++
Phosphoglycerate kinase
3-phosphoglycerate + ATP
The toxicity of arsenic is due to competition of arsenate with inorganic
phosphate in the above reactions to give l-arseno-3-phosphoglycerate,
which hydrolyzes spontaneously to give 3-phosphoglycerate + heat,
without generating ATP.
Reaction 7: Isomerization
In this reaction the phosphate group moves from the 3 position of 3-
phosphoglycerate to the 2 position in an isomerization reaction
producing 2-phosphoglycerate.
This reversible reaction is catalyzed by Phosphoglycerate mutase
enzyme.
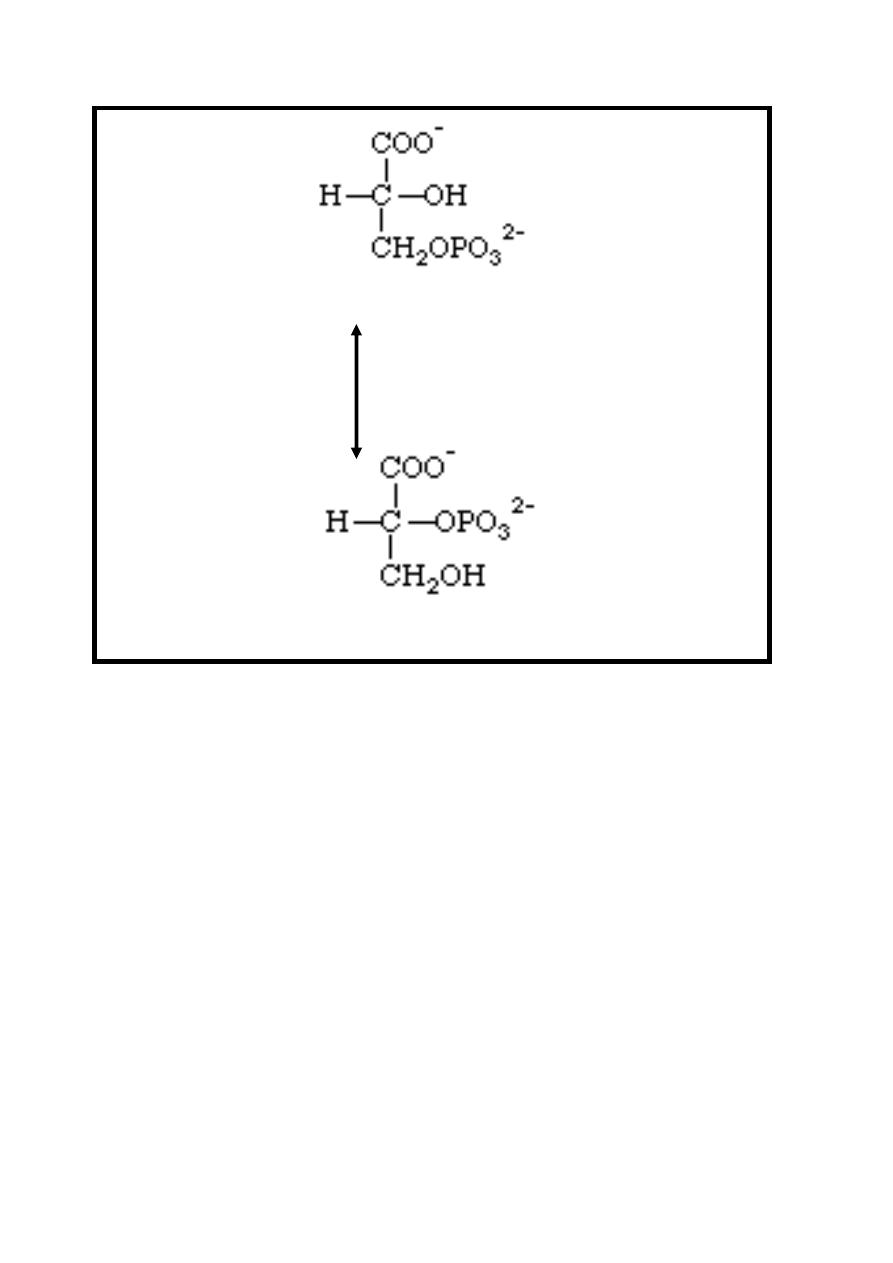
11
3-phosphoglycerate
Phosphoglycerate mutase.
2-phosphoglycerate
Reaction 8: Alcohol Dehydration (Enolation)
In this reversible reaction, dehydration of 2-phosphoglycerate
forming phosphoenolpyruvate, this reaction is catalyzed by
Enolase enzyme which is dependent on the presence of either
Mg
++
or Mn
++
ions
& inhibited by fluoride which is used as a
preservative of blood sample to prevent in vitro glycolysis in the
estimation of glucose.
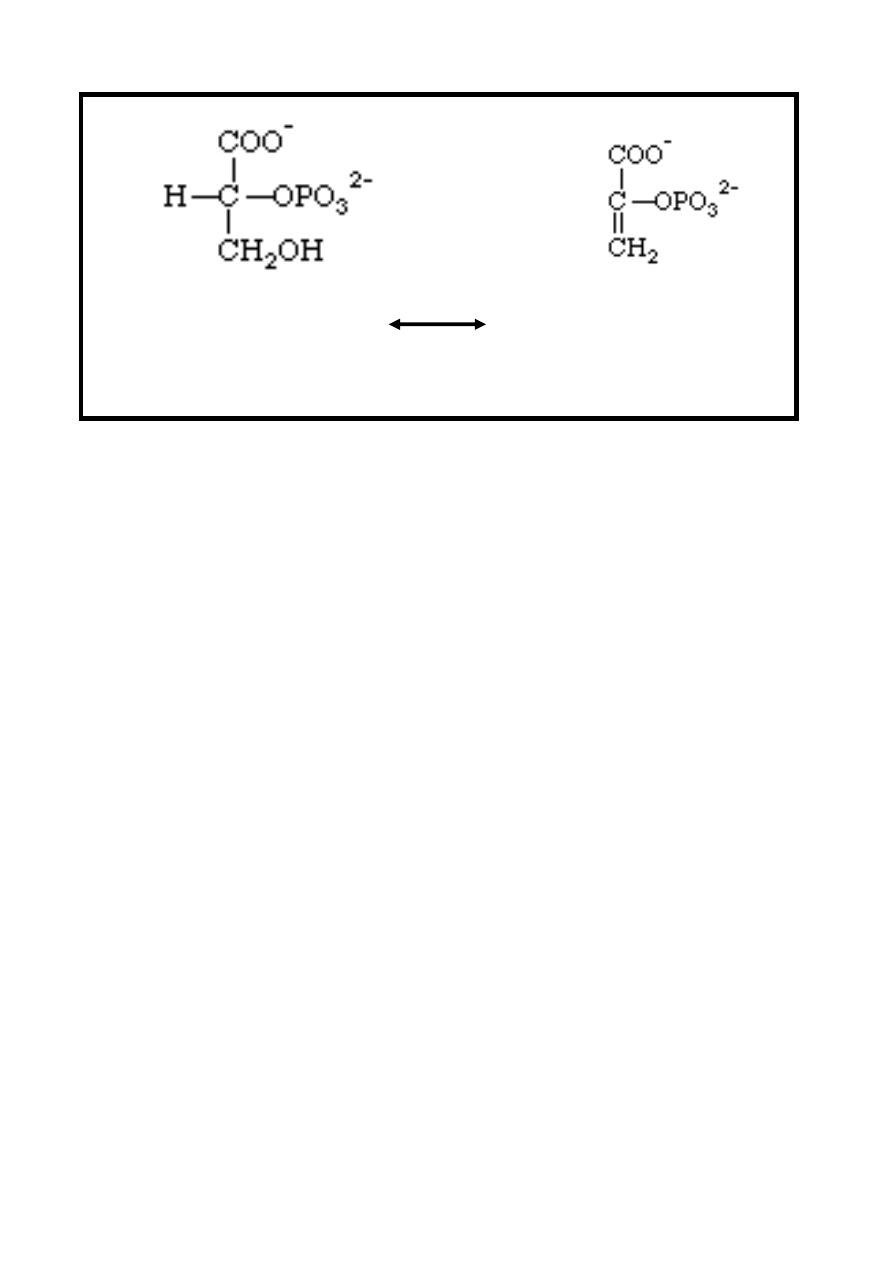
12
Mg
++
/ Mn
++
2-phosphoglycerate Phosphoenolpyruvate
Enolase
+ H
2
O
Reaction 9: Phosphate Ester Hydrolysis, Synthesis of ATP
this is the final reaction in glycolysis. phosphate group of
phosphoenolpyruvate is transferred to ADP forming ATP while
Phosphoenolpyruvate is converted into enolpyruvate which
undergoes spontaneous (nonenzymic) isomerization to pyruvate
,therefore , at this stage two molecules of ATP are produced /
molecule of glucose undergo glycolysis.
This irreversible reaction is catalyzed by pyruvate kinase
enzyme in the presence of magnesium.
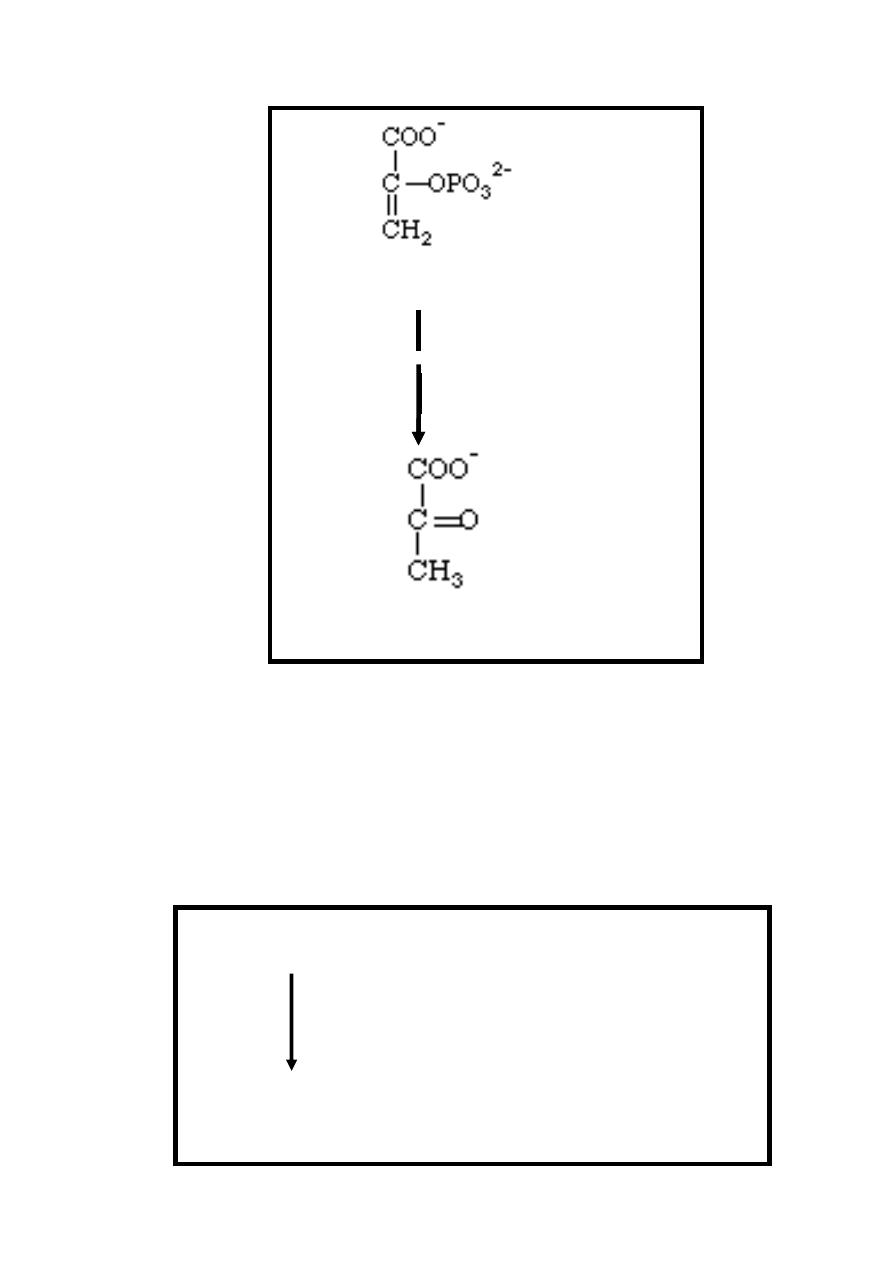
13
Phosphoenolpyruvate + ADP
Mg
++
Pyruvate kinase
Pyruvate + ATP
Fate of pyruvate depending on availability of aerobic or
anaerobic conditions:
1-Aerobic condition: pyruvate is transported from the cytoplasm
to the mitochondria via special pyruvate transporter & within
the mitochondria it's oxidatively decarboxylated into acetyl Co-
A (active acetate) by several different enzymes working
sequentially in a multienzyme complex called collectively as
pyruvate dehydrogenase complex system.
Pyruvate + NAD
+
+ CoA-SH
Pyruvate dehydrogenase complex
Acetyl CoA+NADH+H
+
+CO
2
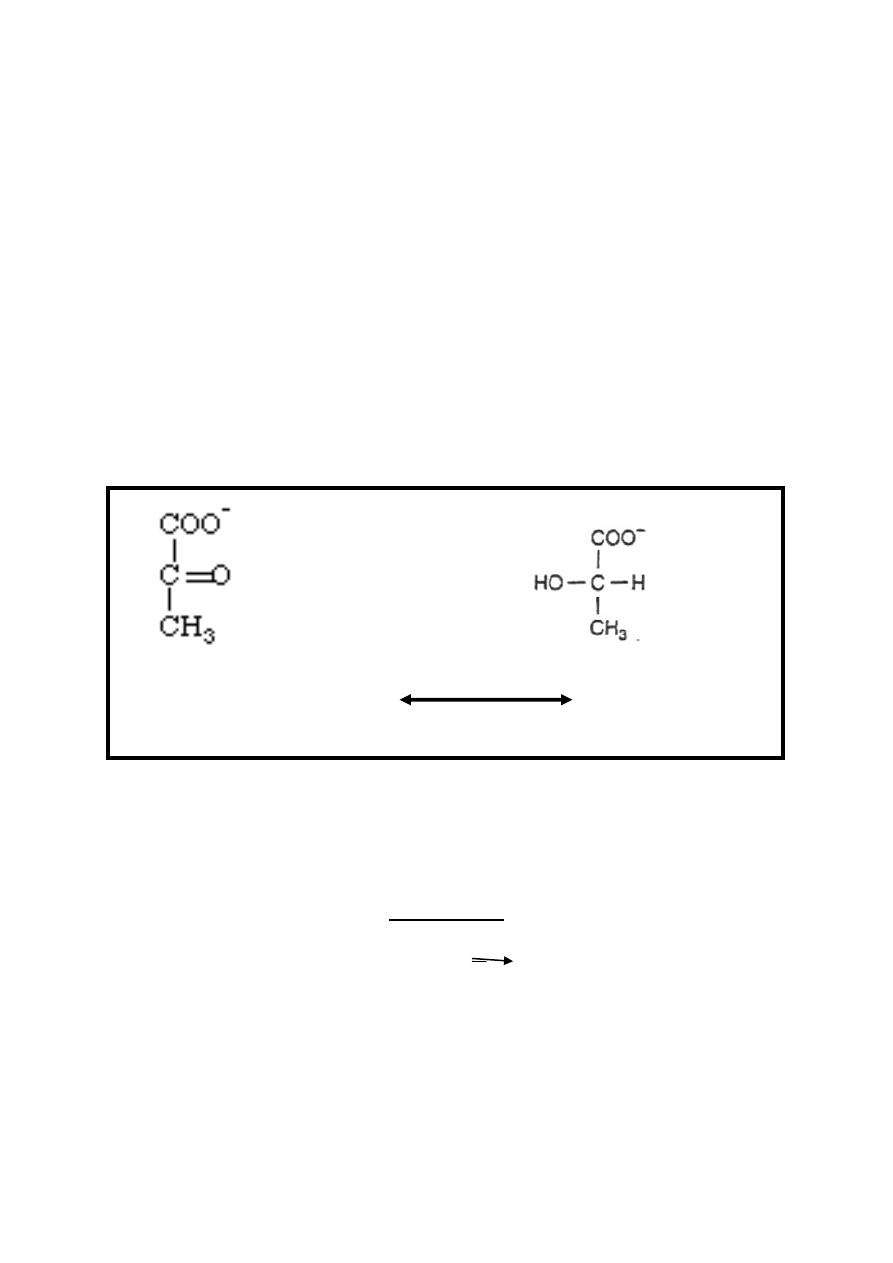
14
The presence of arsenate or deficiency of thiamin inhibit
pyruvate dehydrogenase allowing pyruvate to accumulate , also
it is inhibited by the product (Acetyl CoA) , therefore , any
source that give rise to acetyl Co-A can inhibit pyruvate
dehydrogenase system as amino acids & fatty acids.
Acetyl Co-A enter citric acid cycle for further energy
production.
2-Anaerobic condition : pyruvate is reduced to lactate by
NADH
+
2
produced in reaction( 5) of glycolysis, this reversible
reaction catalyzed by lactate dehydrogenase enzyme with
production of NAD
+
allowing glycolysis to proceed in anaerobic
conditions by regenerating sufficient NAD
+
for reaction( 5) to
continue.
Pyruvate+NADH+H
+
lactate
Lactate+NAD
+
dehydrogenase
Therefore, tissues that can function under hypoxic condition can
produce lactate as in skeletal muscle & RBC (even under
aerobic condition because it has no mitochondria).
Conclusion
1-Glycolysis is represented simply as:
glucose + 2 NAD
+
+ 2 ADP + 2 P 2 pyruvate + 2 ATP + 2
NADH + 2 H
+
2-Glucose with six carbons is converted into two pyruvate
molecules with three carbons each. The ATP produced is as
follow:-

15
A-Anaerobic conditions:-2 ATP are produced (2ATP produced
at reaction 6 + 2 ATP at reaction 9 - 2ATP consumed at
reactions 1 &3).
B-Aerobic conditions:-
2 ATP are produced as in anaerobic conditions.
+
5 ATP are produced from entrance of two NADH
2
+
molecules
+
produced at reaction 5 to respiratory chain (each NADH
2
+
++
molecule produce 2.5 ATP molecules)
+5 ATP molecules generated by entrance of two NADH
2
+
molecules (produced from conversion of two molecules of
pyruvate into two molecules of acetyl-CoA / one molecule of
glucose) to respiratory chain.
+ 20 ATP are produced from the citric acid cycle.
Therefore the total ATP molecules that produced at aerobic
conditions are 2+5+5+20= 32 ATP molecules.
3-Three reactions ((1, 3, and 9)) are irreversible regulating
glycolysis while the rest of reactions are reversible.
4-Glycolysis reaction can be blocked at reaction 5 by
iodoacetate & at reaction 8 by fluoride, therefore, iodoacetate &
fluoride are used as preservative of blood sample for glucose
estimation.
16
Clinical Aspects
1-Inhibition of Pyruvate Metabolism Leads to Lactic Acidosis,
the main causes of this inhibition are:-
A-Arsenite inhibit pyruvate dehydrogenase complex.
B-Thiamin is a coenzyme for pyruvate dehydrogenase, therefore,
its deficiency lead to lactic acidosis..

17
C-Inherited pyruvate dehydrogenase deficiency presented with
lactic acidosis, particularly after a glucose load.
Because of its dependence on glucose as a fuel. , brain is a
prominent tissue where these metabolic defects manifest
themselves in neurological disturbances.
2- Inherited aldolase deficiency & pyruvate kinase deficiency in
erythrocytes cause hemolytic anemia.
3-
The
exercise
capacity
of
patients
with
muscle
phosphofructokinase deficiency is low, particularly on high-
carbohydrate diets.
4- Competition of arsenate with inorganic phosphate to give l-
arseno-3-phosphoglycerate, which hydrolyzes spontaneously to give
3-phosphoglycerate + heat, without generating ATP.

18
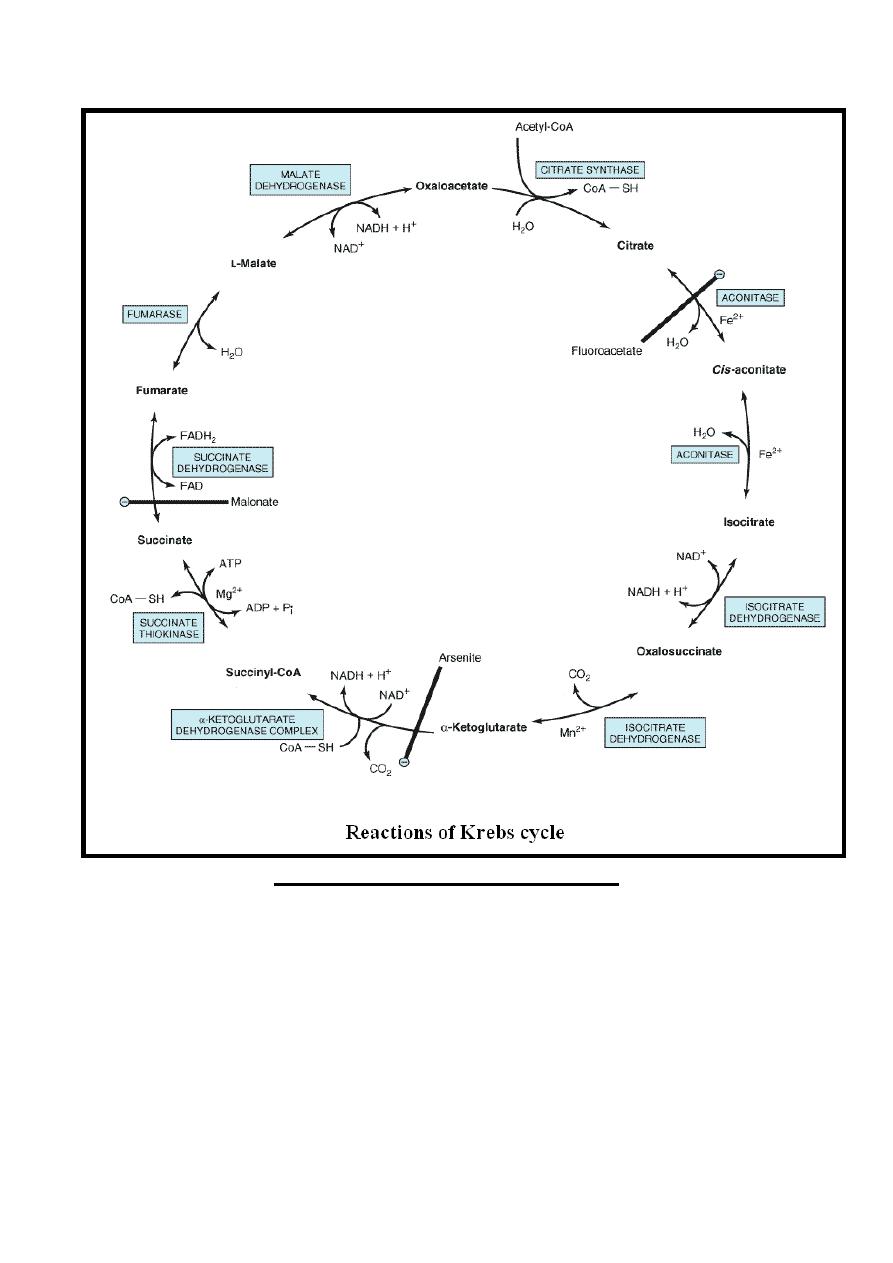
Citric Acid Cycle {Krebs cycle , Tricarboxylic Acid Cycle }
It is a series of reactions discovered by Hans Krebs in 1937
occur in the mitochondria that oxidize acetyl-CoA to CO
2
+H
2
O
in addition to the production of reducing equivalents (NADH
2
and FADH
2
) that upon reoxidation in the respiratory chain ATP
are formed.
Its dependant on oxygen availability, therefore, absence (anoxia)
or deficiency (hypoxia) of oxygen leads to total or partial
inhibition of the cycle respectively.
Overview of Acetyl Co- A Metabolism
1-Acetyl Co-A is at the confluence of the major metabolic
pathways of carbohydrate, lipid & protein.
2-Acetyl Co-A serves as source of acetyl units in the anabolic
processes responsible for synthesis of long chain fatty acids,
cholesterol, steroid & ketone bodies.
3-Catabolism of acetyl Co-A in the citric acid cycle.
Importance of Citric Acid Cycle
1-Final common pathway for the aerobic oxidation of
carbohydrate, lipid & protein because glucose, fatty acids &
most amino acids are metabolized to acetyl-CoA or intermediates
of the cycle.
2-Central role in gluconeogenesis, lipogenesis & interconversion
of amino acids.
3-Liberation of much free energy from oxidation of
carbohydrate, lipid & protein.
4-Formation of reducing equivalents which enter the respiratory
chain for energy production.
Reactions of Citric Acid Cycle
Reaction 1: Synthesis of Citrate
Condensation of acetyl Co-A & oxaloacetate to form citrate &
release of CoA-SH, this irreversible reaction is catalyzed by
citrate synthase enzyme.
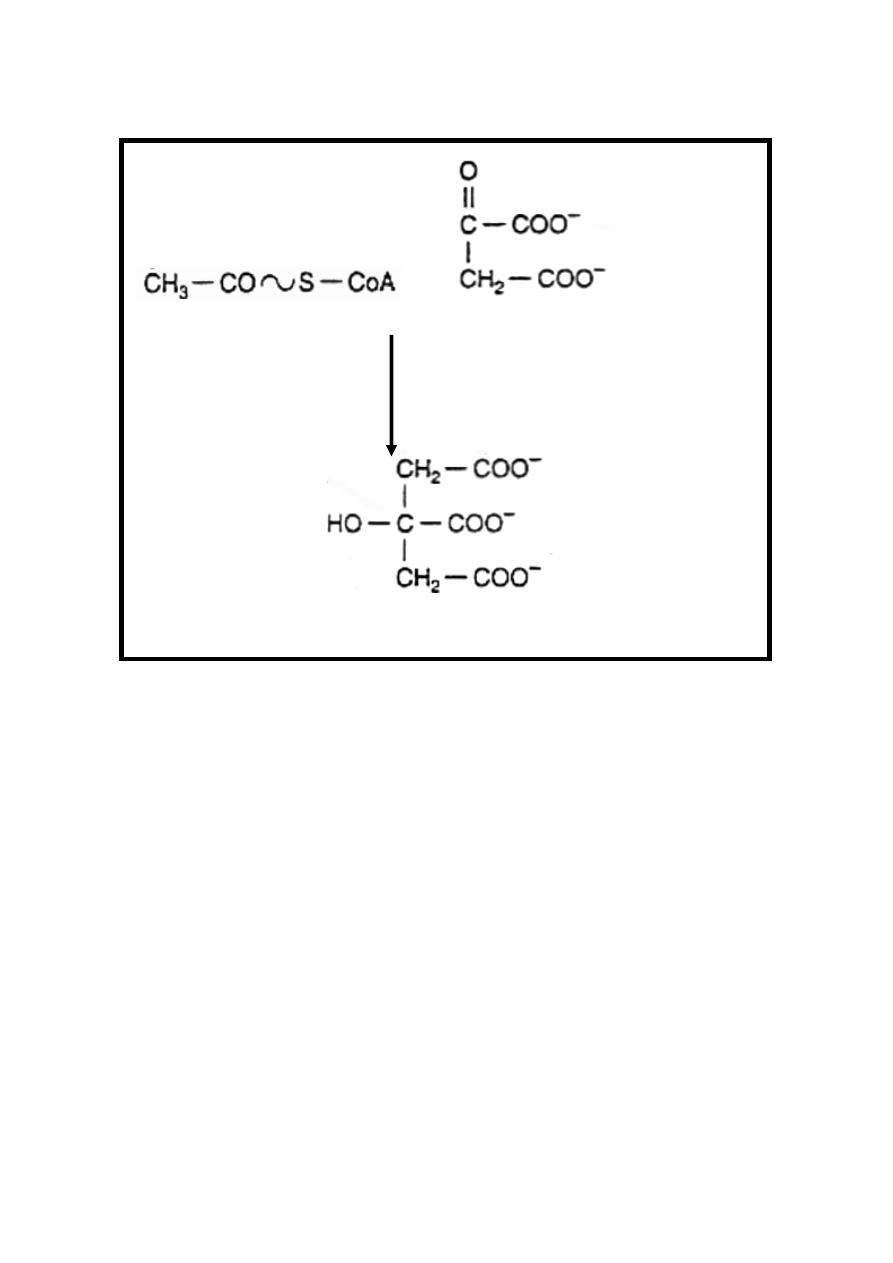
19
Acetyl Co-A + Oxaloacetate + H
2
O
Citrate synthase
Citrate + CoA-SH
Reaction 2: Dehydration & Rehydration
Citrate is isomerized to isocitrate by the enzyme aconitase
((aconitate hydratase)) in the presence of iron in the Fe
++
state.
This reversible reaction takes place in two steps :
Step 1/dehydration of citrate to cis-aconitate (intermediate)
which is enzyme bound.
Step 2 /rehydration of cis-aconitate to isocitrate.
The poison fluoroacetate is toxic because fluoroacetyl-CoA
condenses with oxaloacetate to form fluorocitrate, which inhibits
aconitase, causing citrate to accumulate.
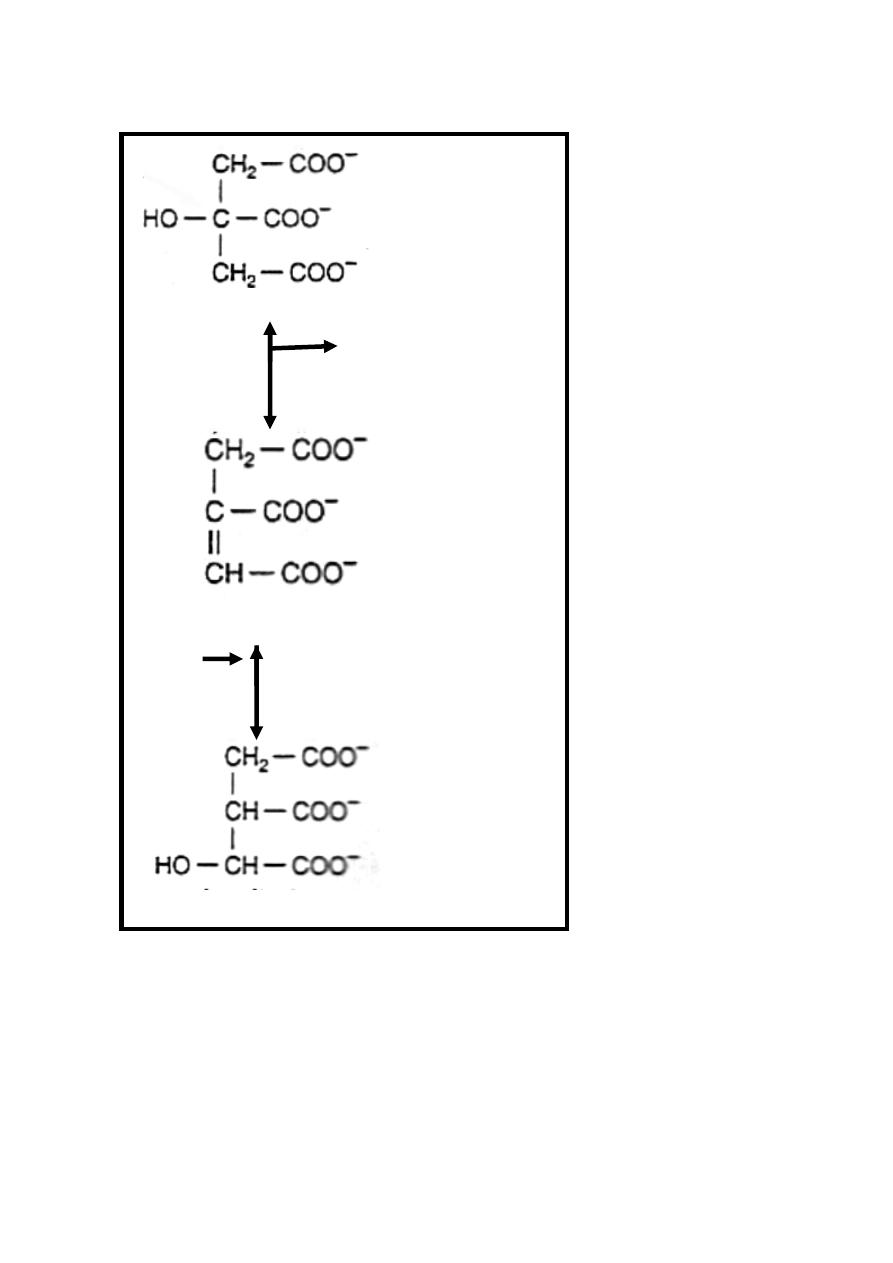
20
Citrate
H
2
O
Aconitase Fe
++
Cis-aconitate
H
2
O
Aconitase Fe
++
Isocitrate
Reaction 3: Dehydrogenation & Decarboxylation
Isocitrate in the presence of NAD
+
is converted to
α-ketoglutarate
.
Although this reaction is reversible its directed
more toward the production of α-ketoglutarate & is catalyzed by
the enzyme isocitrate dehydrogenase & it occurs in two steps:
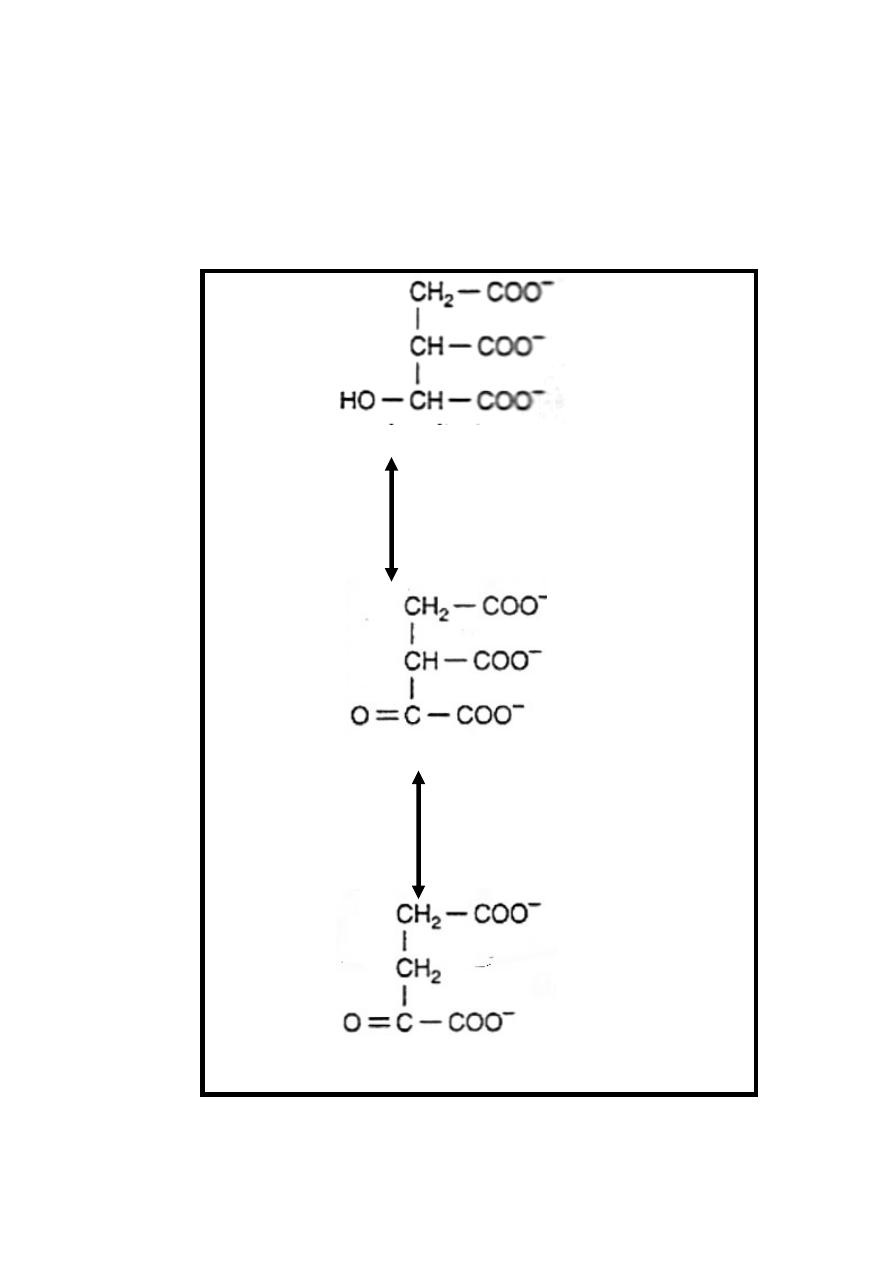
21
Step 1/dehydrogenation of isocitrate in the presence of NAD
+
to
oxalosuccinate ((intermediate& enzyme bound)) +NADH+H
+
Step2/decarboxylation of oxalosuccinate to α-ketoglutarate +
+CO
2,
Mn
++
or Mg
++
is an important component of the
decarboxylation reaction.
Isocitrate + NAD
+
Isocitrate Dehydrogenase
Oxalosuccinate +NADH +H
+
An
Isocitrate Mn
++ /
Mg
++
Dehydrogenase
α-ketoglutarate +CO
2
22
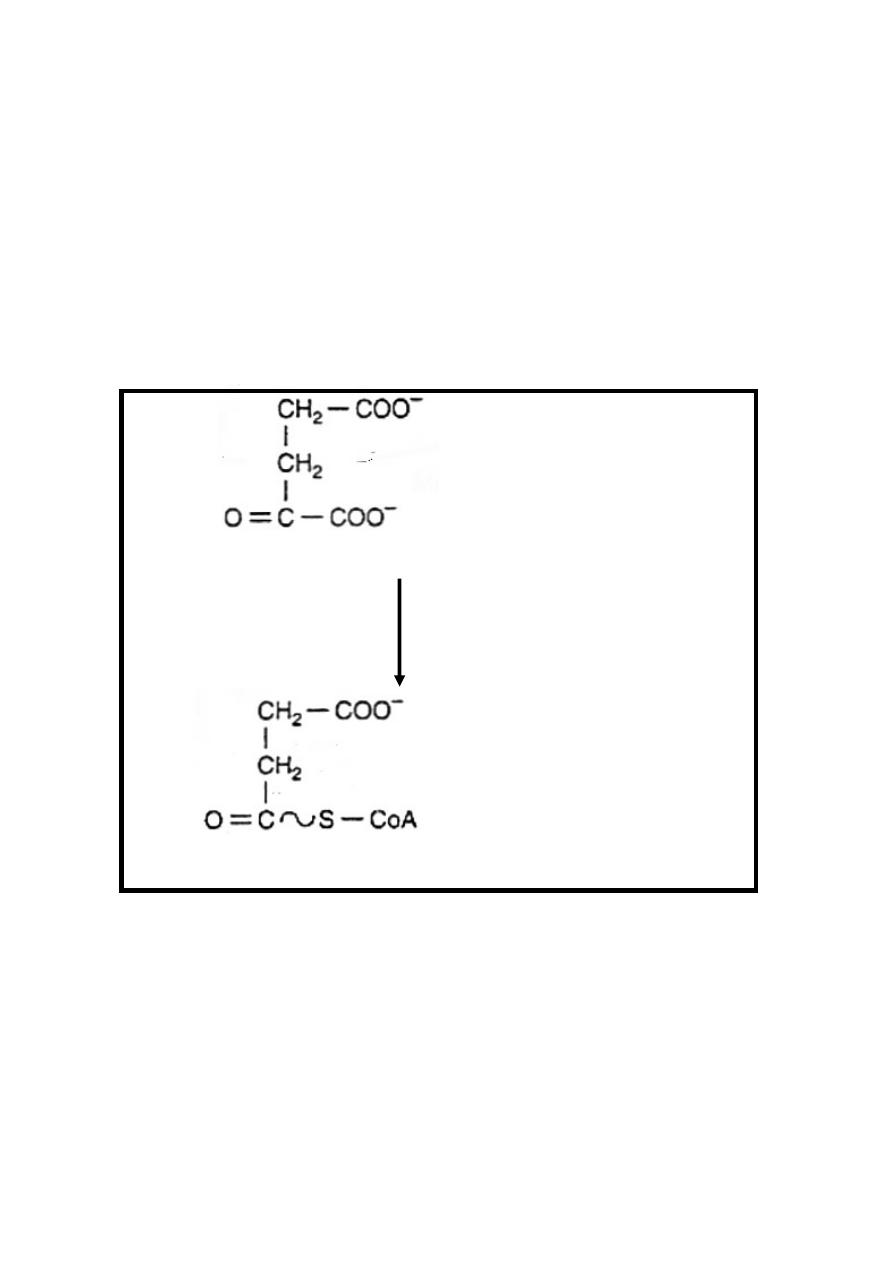
Reaction 4:Oxidation&Decarboxylation (Oxidative decarboxylation)
α-ketoglutarate undergoes oxidative decarboxylation (similar to
conversion of pyruvate into acetyl Co-A) .This irreversible
reaction is catalyzed by α-ketoglutarate dehydrogenase
complex which require also identical cofactors to that of
pyruvate dehydrogenase as thiamin diphosphate& is inhibited
by arsenate causing accumulation of α-ketoglutarate.
In this reaction α-ketoglutarate in the presence of NAD
+
&
CoA-SH result in the formation of succinyl -CoA (contain high
energy bond) +NADH + H
+
+ CO
2
α-ketoglutarate + NAD
+
+ CoA-SH
α-ketoglutarate
dehydrogenase complex
Succinyl –CoA + CO
2
+ NADH + H
+
Reaction 5: Hydrolysis of Succinyl-CoA, Synthesis of ATP
Succinyl-CoA in the presence of ADP & inorganic phosphate
(Pi) is converted into succinate +ATP + CoA-SH.
This is the only reaction in the citric acid cycle include the
generation of ATP at substrate-level.
This reversible reaction is catalyzed by succinate thiokinase
enzyme in the presence of Mg
++
.
Succinate thiokinase also share in gluconeogenesis
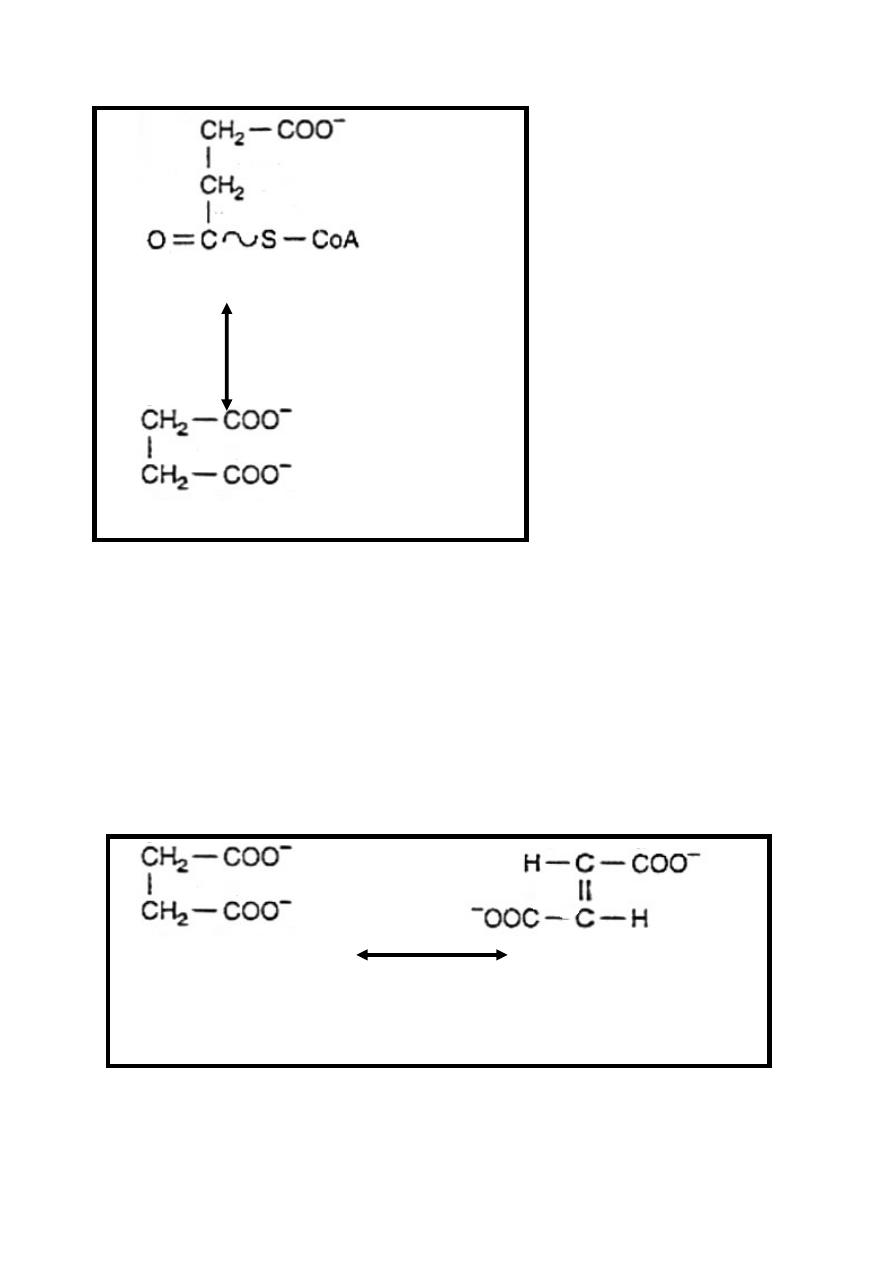
23
Succinyl-CoA + Pi + ADP
Mg
++
Succinate thiokinase
Succinate + ATP +CoA-SH
Reaction 6: Dehydrogenation
Dehydrogenation of succinate into fumarate by transfer of
hydrogen directly from substrate into a flavoprotein it is the only
dehydrogenation reaction in the cycle involving direct transfer
of hydrogen from substrate into a flavoprotein, without
participation of NAD, this reversible reaction is catalyzed by
succinate dehydrogenase enzyme which is inhibited by
malonate resulting in succinate accumulation.
Succinate+FAD Fumarate+FADH
2
Succinate
dehydrogenase
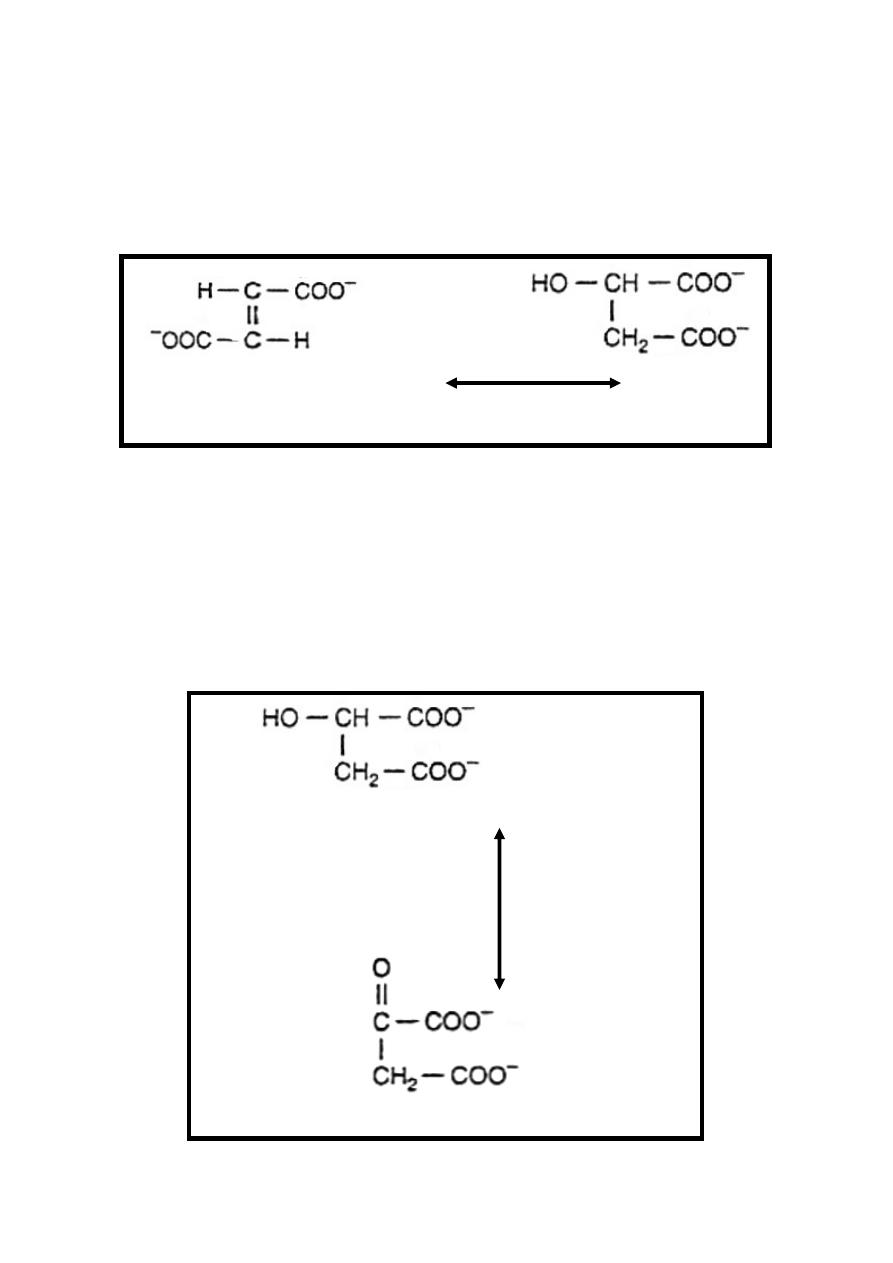
24
Reaction 7: Hydration
Hydration of the double bond of fumarate to form L-Malate.
This reversible reaction is catalyzed by fumarase (fumarate
hydratase) enzyme.
Fumarate + H
2
O L-Malate
Fumarase
Reaction 8: Dehydrogenation
This is the final reaction of the citric acid cycle where
dehydrogenation of malate in the presence of NAD
+
into
oxaloacetate + NADH + H
+
.This reversible reaction is catalyzed
by the enzyme Malate dehydrogenase.
The oxaloacetate produced in this reaction condense with
acetyl-CoA (Reaction 1: Synthesis of Citrate) & so the cycle
continue again.
L-Malate +NAD
+
Malate dehydrogenase
Oxaloacetate + NADH + H
+

25
Energetic of Citric Acid Cycle
Reaction 3-produce oneNADH
2
+
molecule which
enter the
respiratory chain producing 2.5 ATP molecules .
Reaction 4- produce oneNADH
2
+
molecule which
enter the
respiratory chain producing 2.5 ATP molecules .
Reaction 5-produce 1 ATP molecule.
Reaction 6-produce one FADH
2
+
molecule which
enter the
respiratory chain producing 1.5 ATP molecules.
Reaction 8- produce oneNADH
2
+
molecule which
enter the
respiratory chain producing 2.5 ATP molecules.
Therefore , 10 ATP molecules are produced for each cycle
from one molecule of acetyl-CoA.
Energy produced of one molecule of glucose under aerobic
conditions when enter citric acid cycle is as follow:
7 ATP molecules up to pyruvate synthesis.
+5 ATP molecules generated by two NADH
2
+
molecules
produced from conversion of two molecules of pyruvate into
two molecules of acetyl-CoA / one molecule of glucose
+20 ATP molecules from entrance of two molecules of acetyl-
CoA / one molecule of glucose to citric acid cycle.
Therefore , 32 ATP molecules are produced.
Regulation of Citric Acid Cycle
1-Proper function of respiratory chain which depend mainly on
the availability of oxygen , ADP & NAD
+
.
2-Regulatory reactions ((irreversible or nearly irreversible)) in
the cycle which are:
Reaction 1: Synthesis of Citrate.
Reaction 3: Dehydrogenation & Decarboxylation.
Reaction 4:Oxidation&Decarboxylation (Oxidative decarboxylation).
26
Role of Vitamins in Citric Acid Cycle
Vitamins play a key role in the citric acid cycle.
(1) Riboflavin, in the form of flavin adenine dinucleotide (FAD)
in reaction 6 (Dehydrogenation).
(2) Niacin, in the form of nicotinamide adenine dinucleotide
(NAD) in three dehydrogenation reactions in the cycle (Reactions
3, 4&8).
(3) Thiamin,
as thiamin diphosphate, the coenzyme for
α-ketoglutarate dehydrogenase reaction.
(4) Pantothenic acid, as part of coenzyme A.

27
Clinical Aspects
The few genetic defects of citric acid cycle enzymes that have
been reported are associated with severe neurological damage as
a result of very considerably impaired ATP formation in the
central nervous system.

28
G
G
l
l
y
y
c
c
o
o
g
g
e
e
n
n
m
m
e
e
t
t
a
a
b
b
o
o
l
l
i
i
s
s
m
m
Glycogen is the major carbohydrate storage in animals including
human, it present mainly in:
1-liver: glycogen represent up to 5% of liver weight, its concern
with maintenance of blood glucose level between the meals.
After 12-18 hours of fasting the liver glycogen is almost totally
depleted.
2-Muscle: glycogen represent up to 0.7% of muscle weight but
because of great muscle mass its about 3-4 times to that of liver ,
its concern as a source of glucose for glycolysis within the
muscle itself.
Metabolisms of glycogen include synthesis (glycogenesis) &
degradation (glycogenolysis); these two processes are not
simply the reversal of one series of reactions but they are
separated reactions.
Glycogenesis
Glycogenesis is the process of glycogen synthesis, in which
glucose molecules are added to chains of glycogen.
Glycogen synthesis depends on the demand for glucose and
ATP (energy). If both are present in relatively high amounts,
then the excess of insulin promotes the glucose conversion into
glycogen for storage in liver and muscle cells.
Reaction 1
Glucose is phosphorylated to glucose 6-phosphate in irreversible
reaction catalyzed by hexokinase in muscle & glucokinase in
liver in the presence of magnesium ion.
Mg
++
Glucose+ATP Hexokinase Glucose 6-P+ADP
Glucokinase
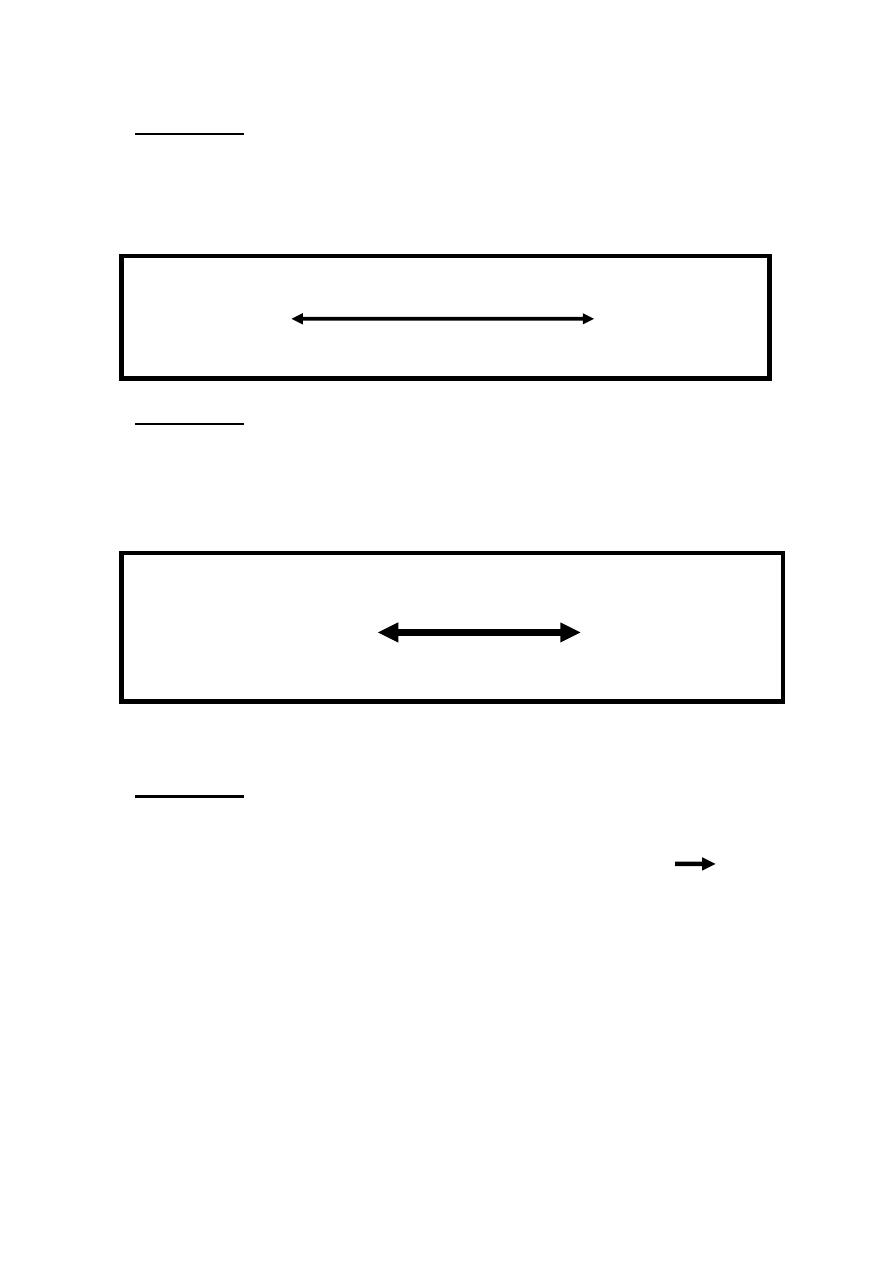
29
Reaction 2
Glucose 6-phosphate is isomerized to glucose 1-phosphate in a
reversible reaction catalyzed by phosphoglucomutase enzyme
in the presence of magnesium ion.
Mg
++
Glucose6-p Glucose1-p
phosphoglucomutase
Reaction 3
Glucose 1-phosphate reacts with uridine triphosphate (UTP) to
form the active nucleotide uridine diphosphate glucose
(UDPGlc) & inorganic pyrophosphate (PPi); this reaction is
catalyzed by UDPGlc Pyrophosphorylase enzyme.
UDPGlc
UTP+Glucose1-p UDPGlc+PPi
Pyrophosphorylase
Although this reaction is reversible but subsequent hydrolysis of
PPi pull the reaction to right.
Reaction 4
Glycogen synthase catalyzes the formation of a glucosidic bond
between C
1
of the activated glucose of UDPGlc and C
4
of a
terminal glucose residue of glycogen primer producing 1 4
Glucosyl units with liberation of uridine diphosphate (UDP).
Therefore the preexisting glycogen primer must be present to
initiate this reaction. This glycogen primer may in turn be
formed on a primer known as glycogenin, which is a protein that
is glycosylated on a specific tyrosine residue by UDPGlc.
This reaction is irreversible.
30
UDPGlc +Glycogenin
Glycogen primer
Glycogen synthetase
+
UDPGlc
UDP
+
1 4 Glucosyl units
Reaction 5
In reaction 4 the branches of the glycogen (tree) become
elongated as successive 1, 4 linkages occur & when the chain
has been lengthened to at least11 glucose residue a second
enzyme called branching enzyme transfer a part of 1,4-chain
(minimum 6 glucose residues) to a neighboring chain to form
1,6 -linkage thus establishing a branch point in the molecule
then the branches grow by further addition of 1 4 glucosyl
units producing glycogen.
This reaction is irreversible.
1 4 Glucosyl units
Branching enzyme
1 4 &1 6 Glucosyl units
((Glycogen))
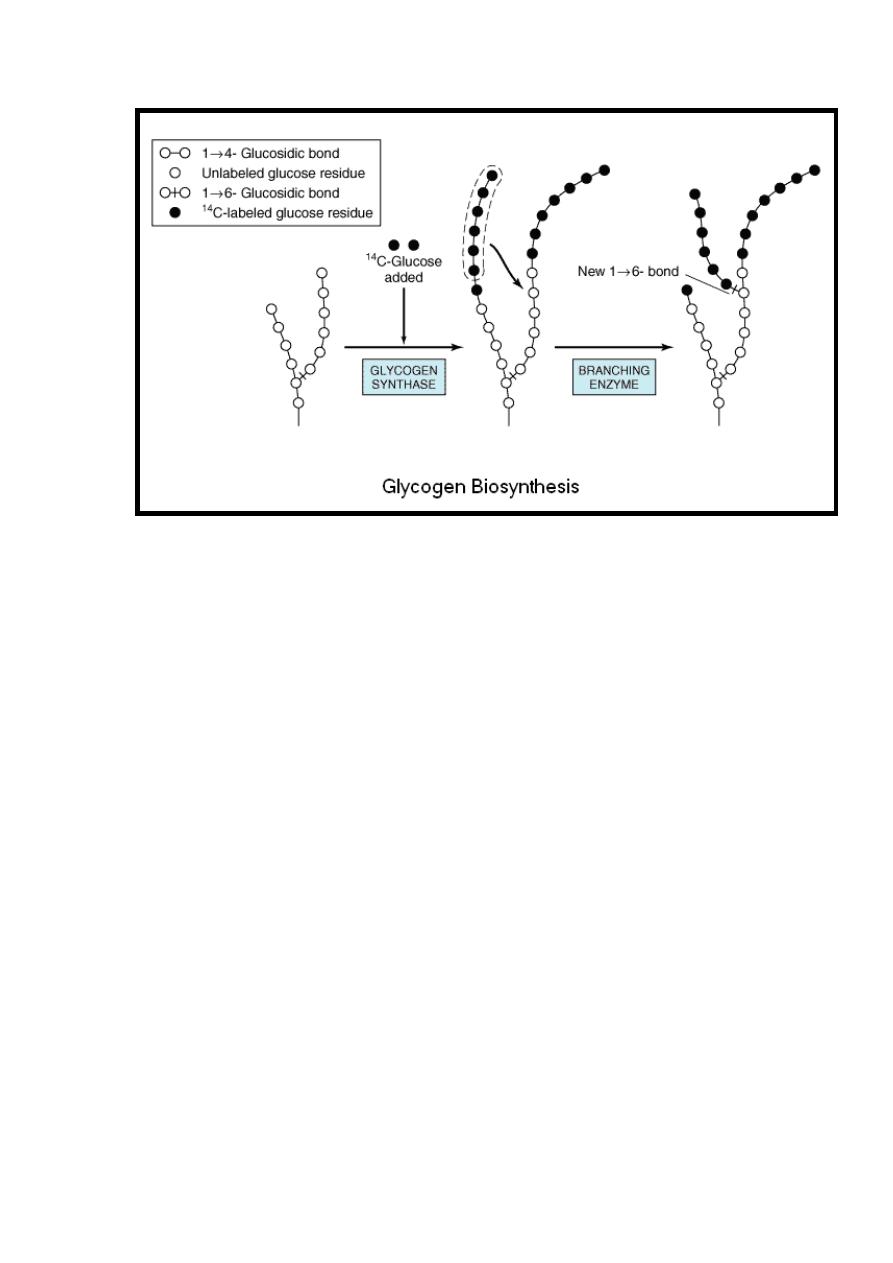
31
The rate limiting reaction of glycogenesis is that reaction
catalyzed by glycogen synthase enzyme.
The incorporation of 1 mol of glucose into glycogen requires
two high energy phosphates (ATP in reaction 1 & UTP in
reaction 3).
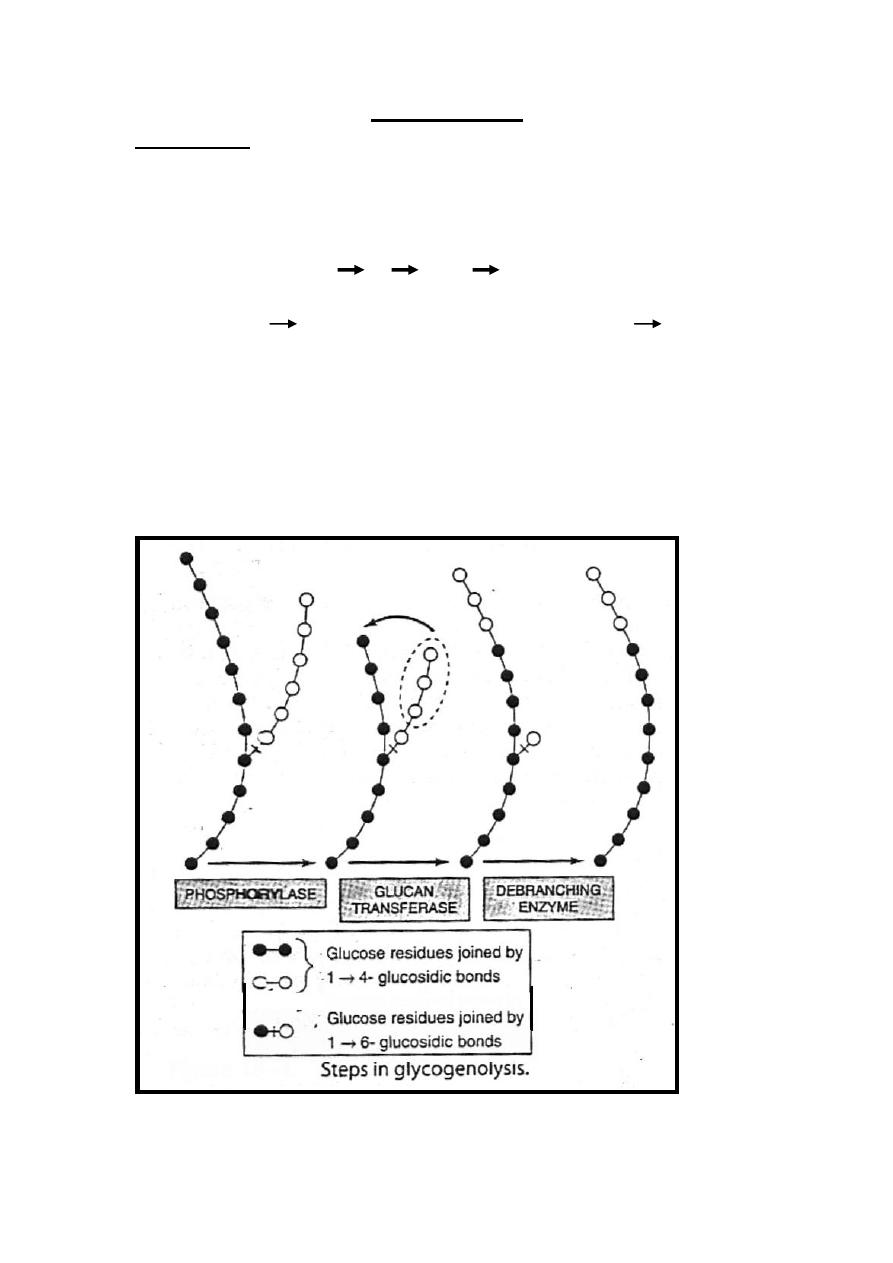
Glycogenolysis
Reaction 1
Glycogenolysis is initiated by the reaction catalyzed by
glycogen phosphorylase enzyme which cause phosphoroylytic
cleavage of 1,4 link of glycogen until approximately 4 glucose
residues remain on either side of 1,6-branch where another
enzyme called (α-[1 4] α-[1 4] glucan transferase)
transfers a trisaccharide unit from one branch to the other,
exposing the 1 6 branch point. Hydrolysis of the 1 6
linkages requires the debranching enzyme. Further
phosphorylase action can then proceed.
The rate limiting reaction in glycolysis is that catalyzed by
phosphorylase enzyme.
Therefore, the combined action of irreversible reactions
catalyzed by these three enzymes convert glycogen to glucose 1-
phosphate.
33
Reaction 2
Glucose 1-phosphate is converted to glucose 6-phosphate by
reversible reaction catalyzed by phosphoglucomutase enzyme
in the presence of magnesium ion.
Mg
++
Glucose1-p Glucose6-p
phosphoglucomutase
Reaction 3
This irreversible reaction occurs only in the liver & kidney (not
in muscle) to remove phosphate from glucose 6-phosphate
enabling glucose to diffuse from the cell to blood, this reaction
is catalyzed by glucose 6-phosphatase enzyme.
Glucose 6-phosphatase
Glucose6-p+H
2
O Glucose + Pi
Regulation of Glycogen Metabolism
Glycogenesis
Glycogenesis is controlled by glycogen synthetase enzyme,
there are two forms of glycogen synthetase which are:
1- Synthetase-a:-Unphosphorylated & most active form.
2- Synthetase-b: - Phosphorylated & inactive.
Synthetase-a is converted to synthetase-b (inactivation) by a
phosphorylation reaction catalyzed by protein kinase enzyme
while conversion of synthetase-b to synthetase-a (activation) by
dephosphorylation reaction catalyzed by protein phosphatase
enzyme which is under the positive control of glucose-6-
phosphate & negative control of cAMP.
Two forms of the protein kinases are present which are:-
A-Ca
++
dependent protein kinase: Stimulated by calcium.
B-cAMP-dependent protein kinase: Stimulated by cAMP.
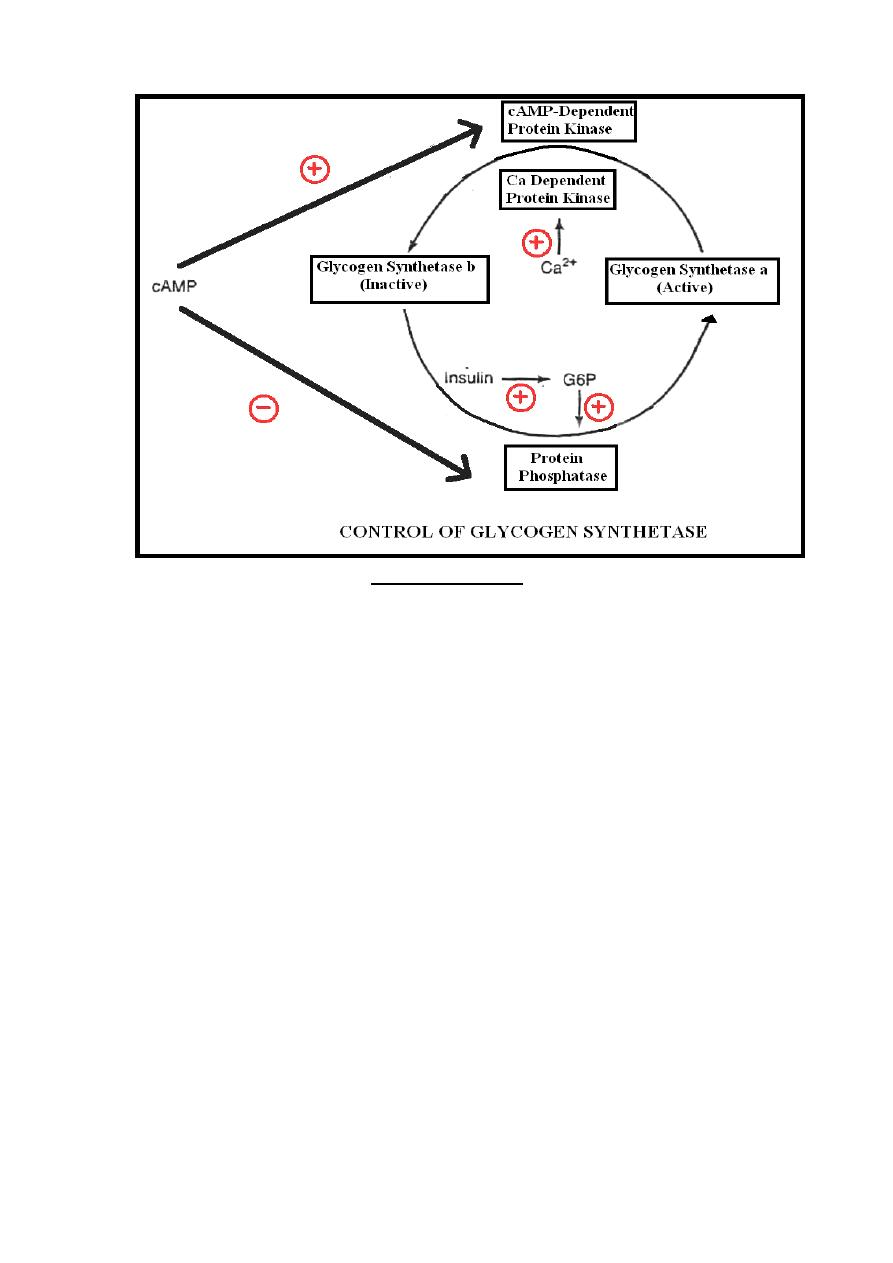
34
Glycogenolysis
Glycogenolysis is controlled by glycogen phosphorylase
enzyme there are two forms of glycogen phosphorylase which
are:-
1-Phosphorylase-a: Phosphorylated & active , inhibited by
glucose 6-phosphate.
2-phosphorylase-b: Unphosphorylated & inactive.
Conversion from a to b forms (inactivation) require
dephosphorylation reaction catalyzed by protein phosphatase
enzyme while conversion of b to a forms (activation) require
phosphorylation reaction catalyzed by phosphorylase kinase
enzyme.
Two forms of phosphorylase kinases are present which are:-
A-cAMP-dependent phosphorylase kinase: Stimulated by
cAMP.
B-Ca-dependant phosphorylase kinase: Stimulated by calcium.
In muscle glycogen phosphorylase enzyme is immunologically
distinct form & it’s more sensitive to c-AMP.
Therefore; cAMP which is stimulated by certain hormones(( as
epinephrine in muscle & glucagon in liver)) inhibit glycogenesis
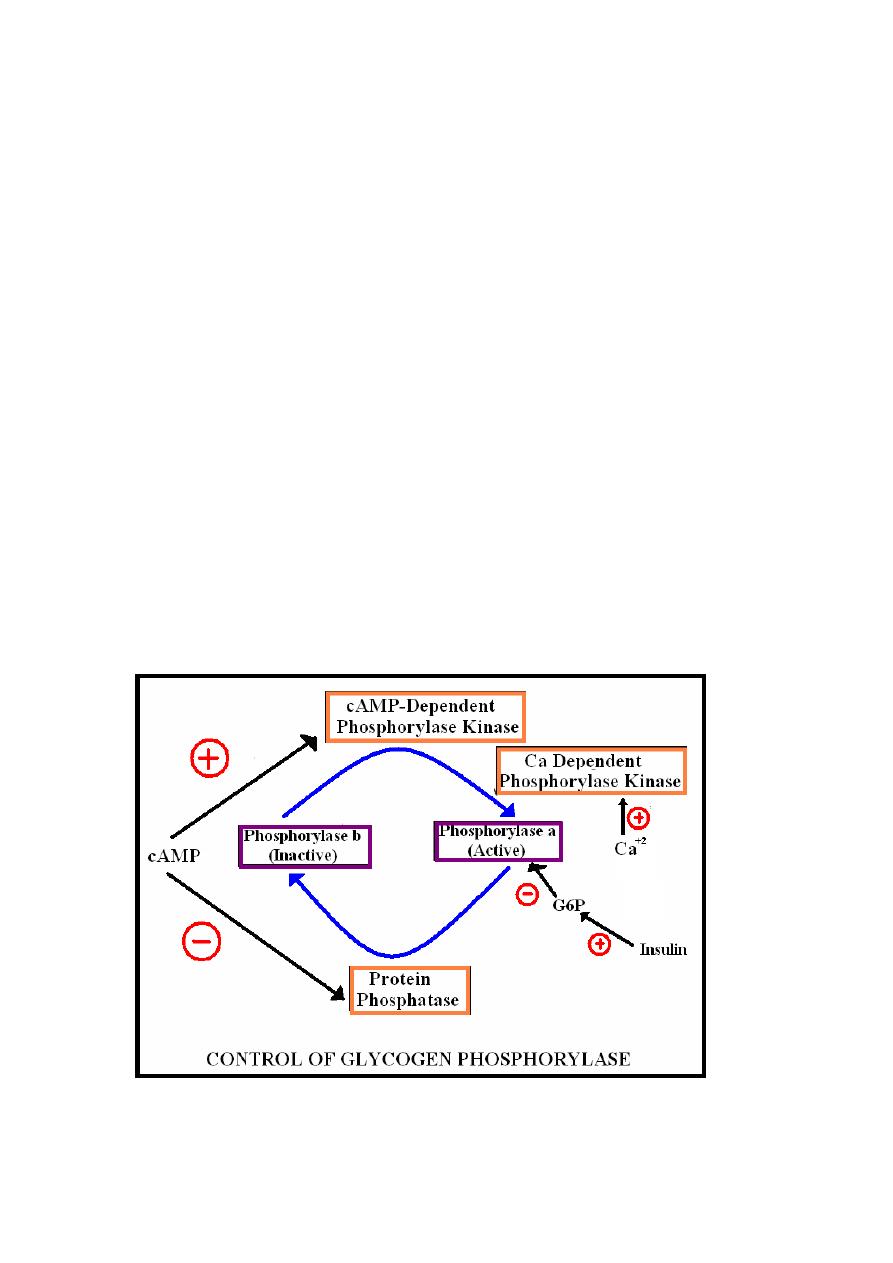
35
synchronously with the activation of glycogenolysis through the
following mechanism:-
I)-cAMP inhibits glycogenesis by:-
1-Inhibition of protein phosphatase enzyme.
2-Stimulation of cAMP-dependent protein kinase enzyme.
II)-cAMP stimulates glycogenolysis by:-
1-Inhibition of protein phosphatase enzyme.
2-Stimulation of cAMP-dependent phosphorylase kinase enzyme.
Calcium ion which may follow muscle contraction inhibit
glycogenesis synchronously with the activation of glycogenolysis
through the following mechanism:-
I)-Stimulate glycogenolysis through the activation of Ca-
dependant phosphorylase kinase.
II)- Inhibit glycogenesis through the activation of Ca dependent
protein kinase.
Insulin inhibit glycogenolysis synchronously with the activation
of glycogenesis through the following mechanism:-
Insulin increasing cellular glucose uptake leads to elevation of
glucose 6-phosphate which inhibit the activity of phosphorylase
a enzyme in glycogenolysis together with stimulation protein
phosphatase enzyme in glycogenesis .

36
Conclusion
Inhibition of glycogenolysis enhances net glycogenesis & vice
versa inhibition of glycogenesis enhances net glycogenolysis. This
occurs by many factors as cAMP , calcium ion & insulin.
Glycogen Storage Diseases((Glycogenosis))
The term ((Glycogen Storage Disease)) is a generic term that
describe a group of inherited disorders (Types) characterized by
deposition of abnormal type or quantity of glycogen due to
partial or complete absence of certain enzymes.
Since glycogen molecules can become enormously large, an
inability to degrade glycogen can cause cells to become
pathologically engorged; it can also lead to the functional loss of
glycogen as a source of cell energy and as a blood glucose
buffer.
The following table summarizes the types of glycogen storage
diseases.
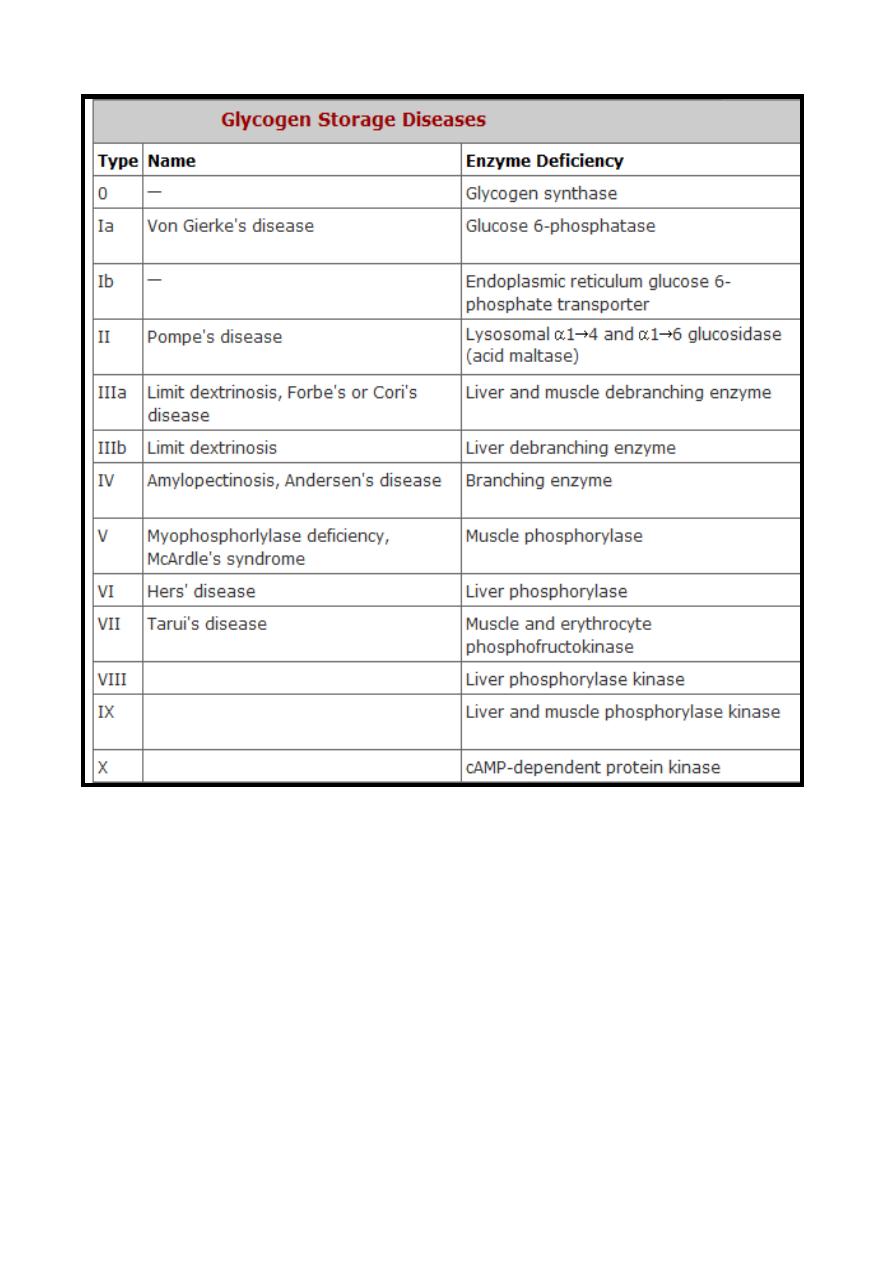
37

38
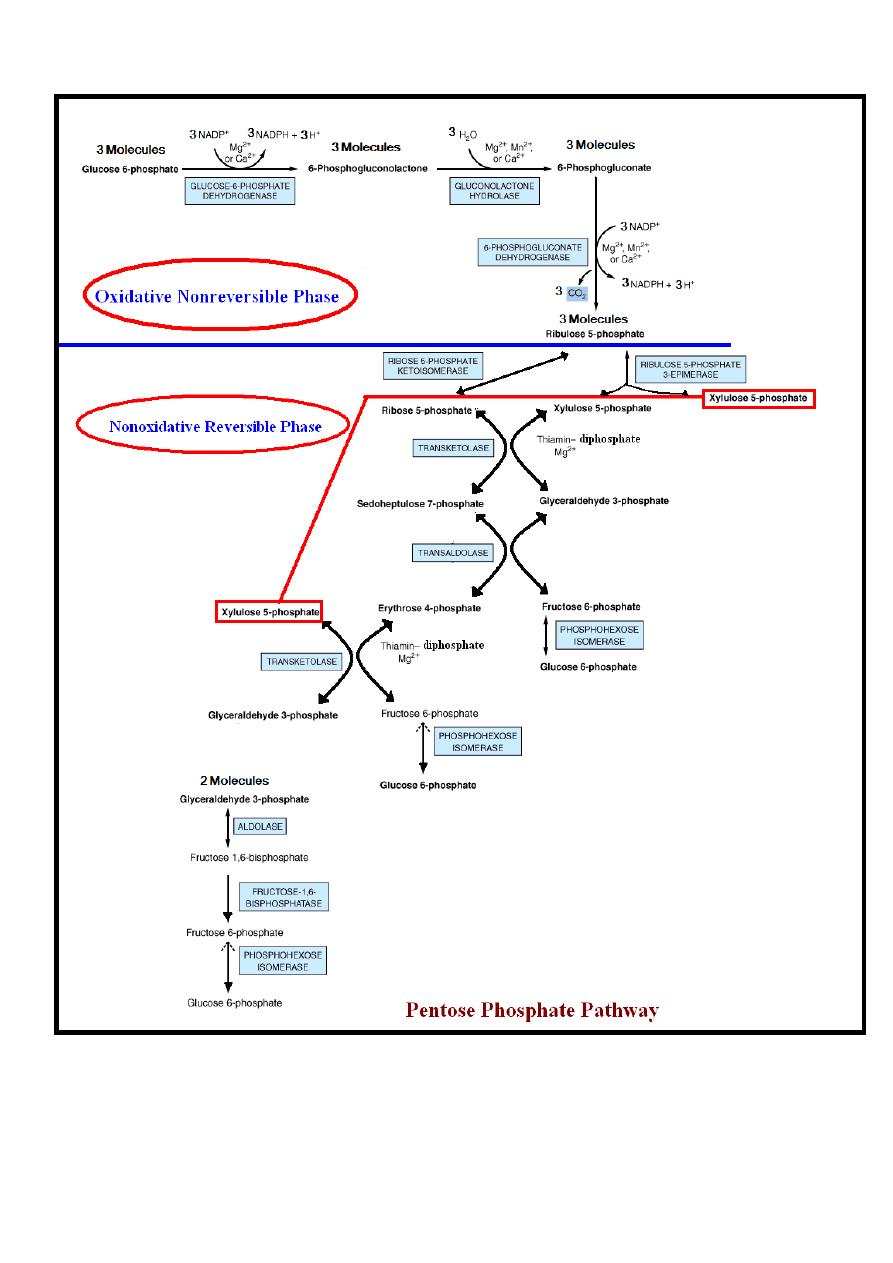
Hexose monophosphate shunt {phosphogluconate
oxidative pathway, pentose phosphate pathway
}
The pentose phosphate pathway is an alternative route for the
metabolism of glucose. It does not generate ATP but has two
major functions:
(1) Formation of NADPH for reduction processes & for synthesis
of fatty acids & steroids.
(2) Synthesis of ribose 5-phosphate for nucleotide & nucleic acid
formation.
Reactions of Pentose Phosphate Pathway
The reactions of the pathway occur in the cytoplasm.
The sequences of reactions are divided into two phases:-
1-Oxidative nonreversible phase.
2-Nonoxidative reversible phase.
Oxidative Nonreversible Phase
Oxidation (dehydrogenation) of glucose 6-phosphate into ribulose
5-phosphate is achieved through the following steps:-
Step 1
Dehydrogenation (oxidation) of glucose 6-phosphate into
6-phosphogluconate occurs via the formation of
6-phosphogluconolactone.
-Dehydrogenation (oxidation) of glucose 6-phosphate into 6-
phosphogluconolactone is catalyzed by glucose-6-phosphate
dehydrogenase enzyme in the presence of NADP
+
which is
converted into NADPH + H
+
.
The hydration of 6-phosphogluconolactone into 6-phosphogluconate
is accomplished by the enzyme gluconolactone hydrolase.
Both reactions of this step require cofactors which are calcium or
magnesium ions.
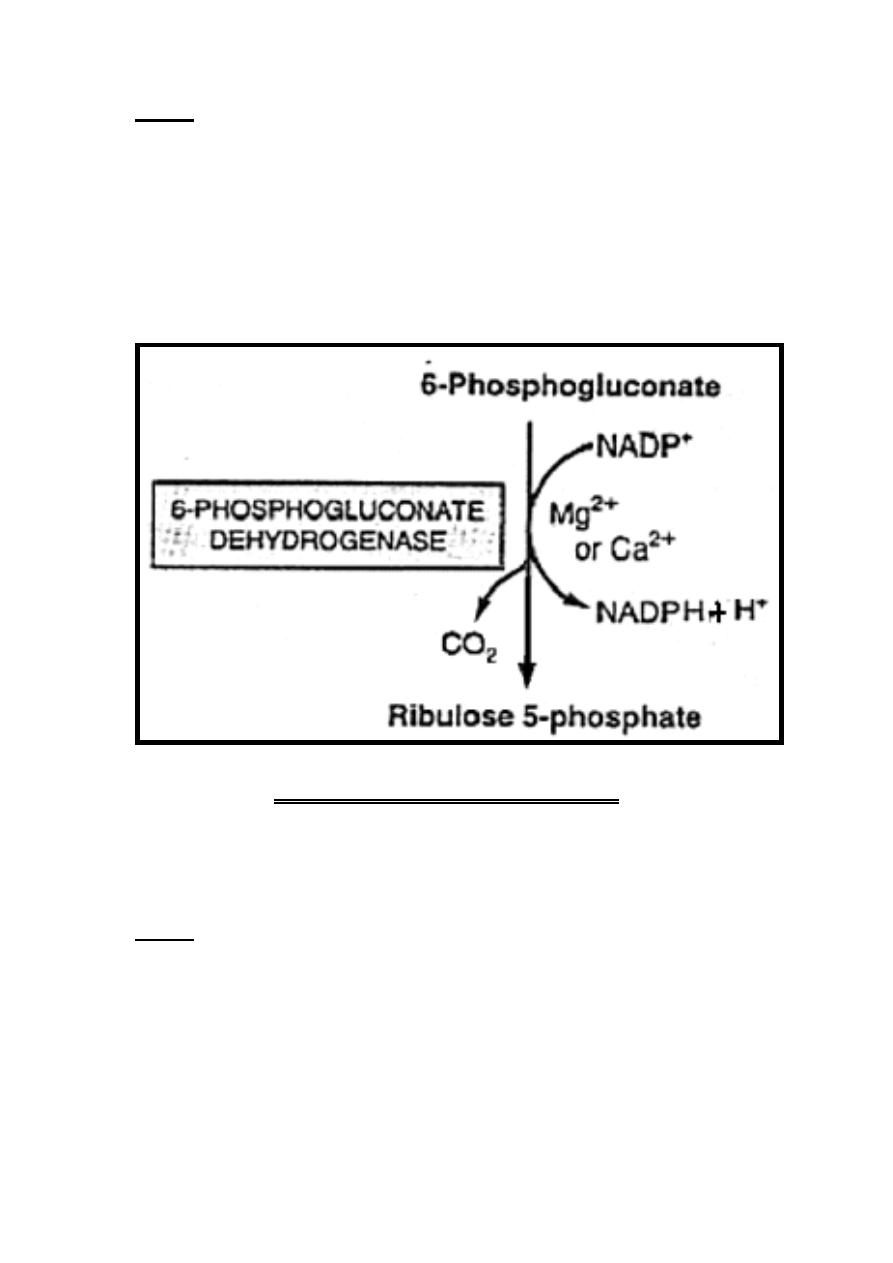
39
Step 2
Dehydrogenation (oxidation) with decarboxylation of
6- Phosphogluconate into a ketopentose known as ribulose 5-
phosphate.
This reaction is catalyzed by the enzyme 6-phosphogluconate
dehydrogenase in the presence of NADP
+
which is converted
into NADPH + H
+
.
This reaction requires cofactors which are calcium or magnesium
ions.
Nonoxidative Reversible Phase
All reactions of this phase are reversible except that reaction
catalyzed by fructose 1, 6-bisphosphatase enzyme which is
irreversible. By this phase ribulose 5-phosphate is end in the
formation of glucose 6-phosphate through the following steps.
Step 1
Ribulose 5-phosphate is the substrate for two enzymes which are:
- A-Ribulose 5-phosphate 3-epimerase alters the configuration
about carbon 3, forming another ketopentose known as
Xylulose 5-phosphate.
B-Ribose 5-phosphate ketoisomerase converts ribulose 5-
phosphate which is a ketopentose to the corresponding
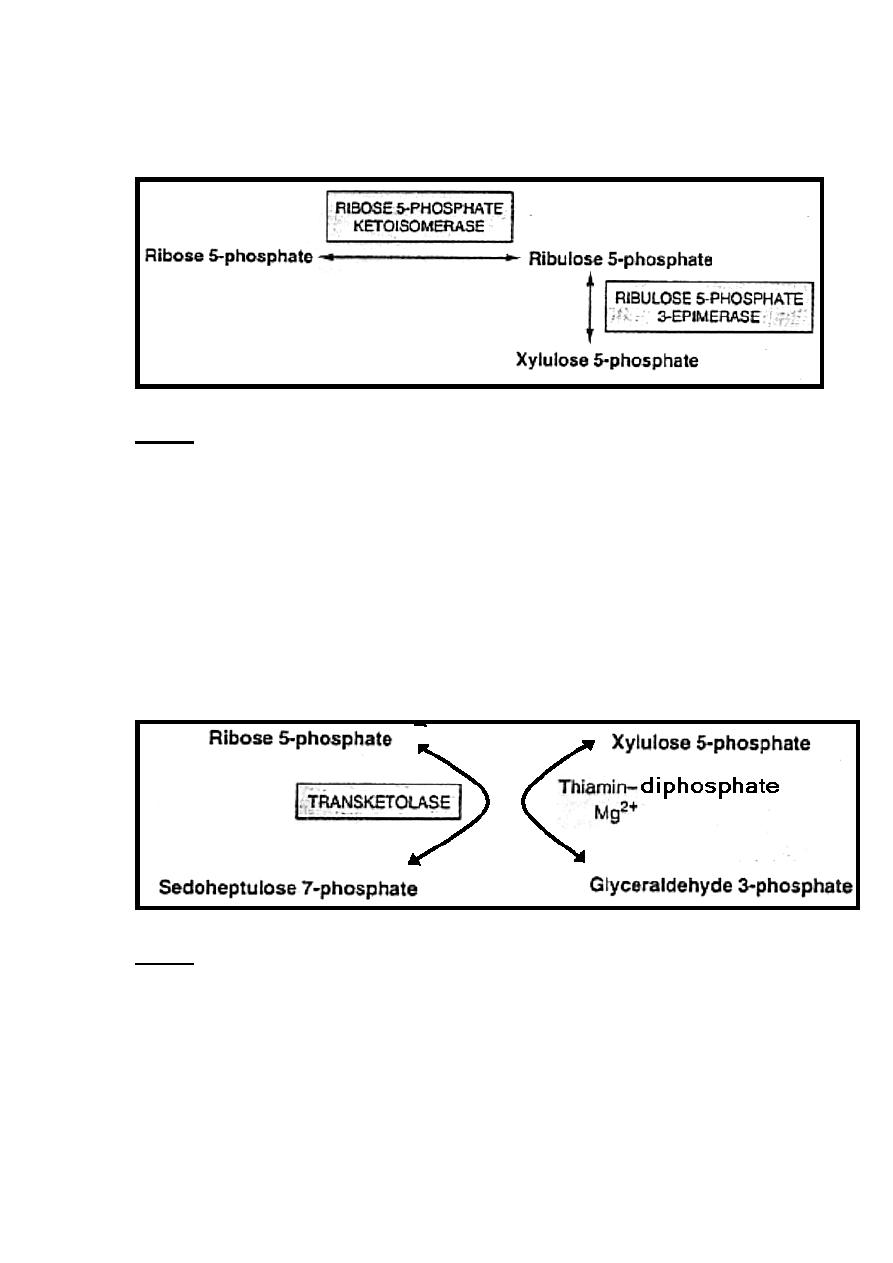
40
aldopentose known as ribose 5-phosphate, which is the precursor
of the ribose required for nucleotide & nucleic acid synthesis.
Step 2
Transketolase enzyme catalyze the conversion of a ketose sugar
into an aldose with two carbons less & simultaneously converts an
aldose sugar into a ketose with two carbons more.
The reaction requires Mg
2+
& thiamin diphosphate (vitamin B
1
)
as coenzyme.
Therefore, transketolase catalyzes the transfer of the two-carbon
unit from the five-carbon ketose (xylulose 5-phosphate) to the five-
carbon aldose (ribose 5-phosphate), producing the seven-carbon
ketose (sedoheptulose 7-phosphate) & the three-carbon aldose
(glyceraldehyde 3-phosphate).
Step 3
Transaldolase allows the transfer of three-carbons (carbons1-3)
from the ketose (sedoheptulose 7-phosphate) onto the aldose
(glyceraldehyde 3-phosphate) to form the six-carbon ketose
(fructose 6-phosphate) & the four-carbon aldose (erythrose 4-
phosphate).
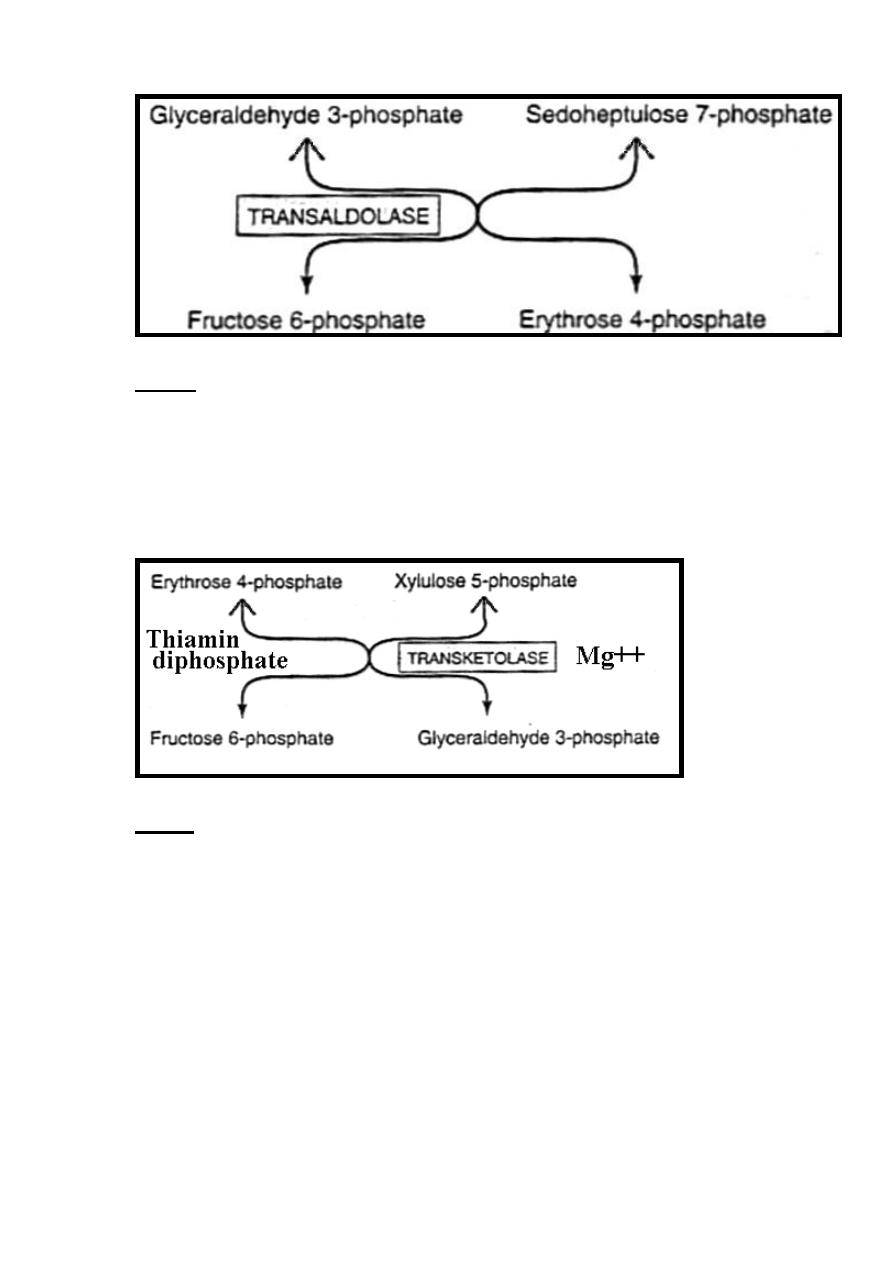
41
Step 4
Transketolase catalyze reaction that involve xylulose 5-
phosphate to donates a two-carbon unit to erythrose 4-phosphate
to form glyceraldehyde 3-phosphate & fructose 6-phosphate.
The reaction requires Mg
2+
& thiamin diphosphate (vitamin B
1
)
as coenzyme.
Step 5
.
In order to oxidize glucose completely, there must be:-
A- Conversion of two molecules of glyceraldehyde 3-phosphate
into one molecule of glucose 6-phosphate .This involves reversal
of glycolysis in addition to the enzyme known as fructose 1, 6-
bisphosphatase.
In tissues that lack fructose 1, 6-bisphosphatase, glyceraldehyde
3-phosphate follows the normal pathway of glycolysis to pyruvate.
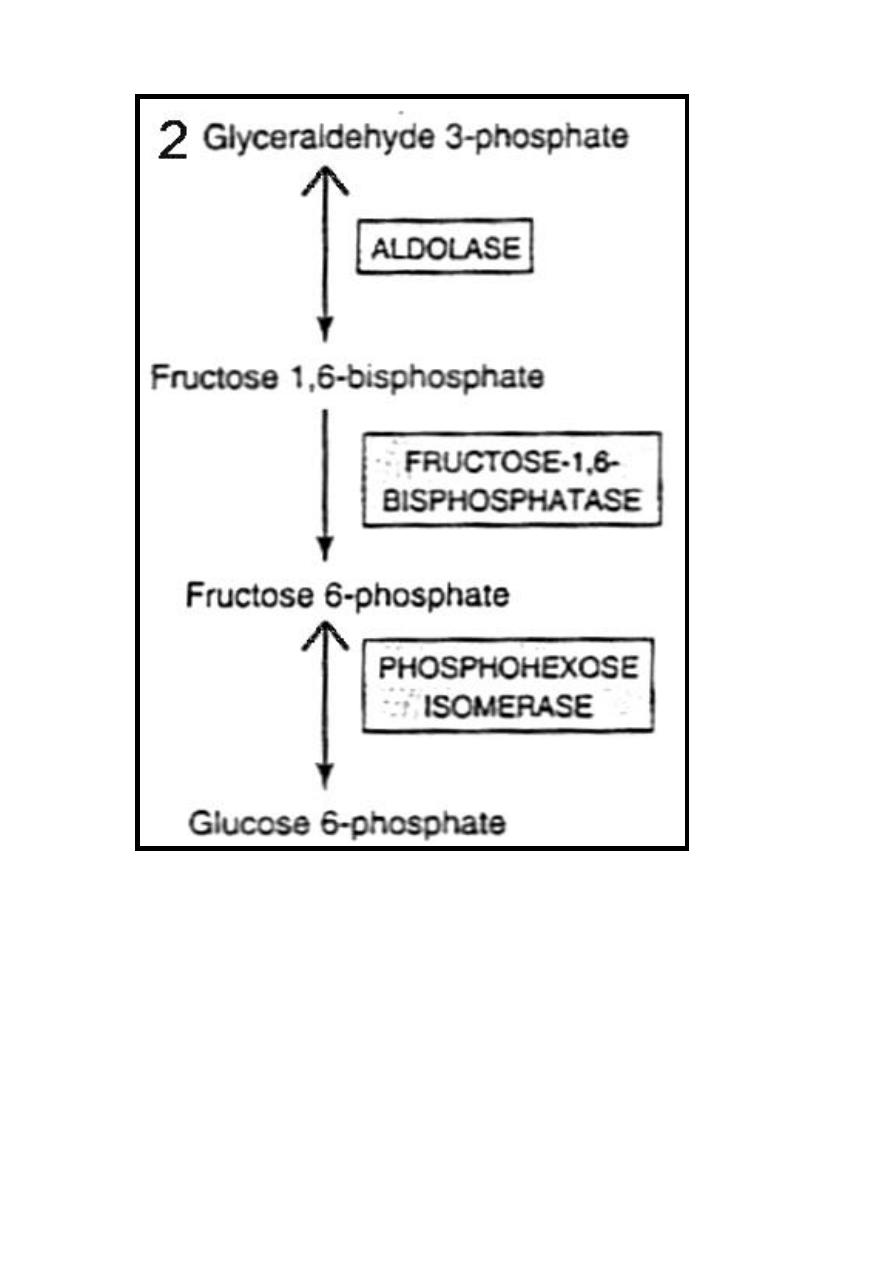
42
B-Conversion of fructose 6-phosphate to glucose 6-phosphate by
phosphohexose isomerase.
Therefore, the net result of pentose phosphate pathway is that
three molecules of glucose 6-phosphate give rise to three
molecules of CO
2
, two molecules of glucose 6-phosphate & one
molecule of glyceraldehyde 3-phosphate. Since two molecules of
glyceraldehyde 3-phosphate can regenerate glucose 6-phosphate,
the pathway can account for the complete oxidation of glucose.
The rate limiting step of pentose phosphate pathway is mainly
controlled by glucose-6-phosphate dehydrogenase enzyme.
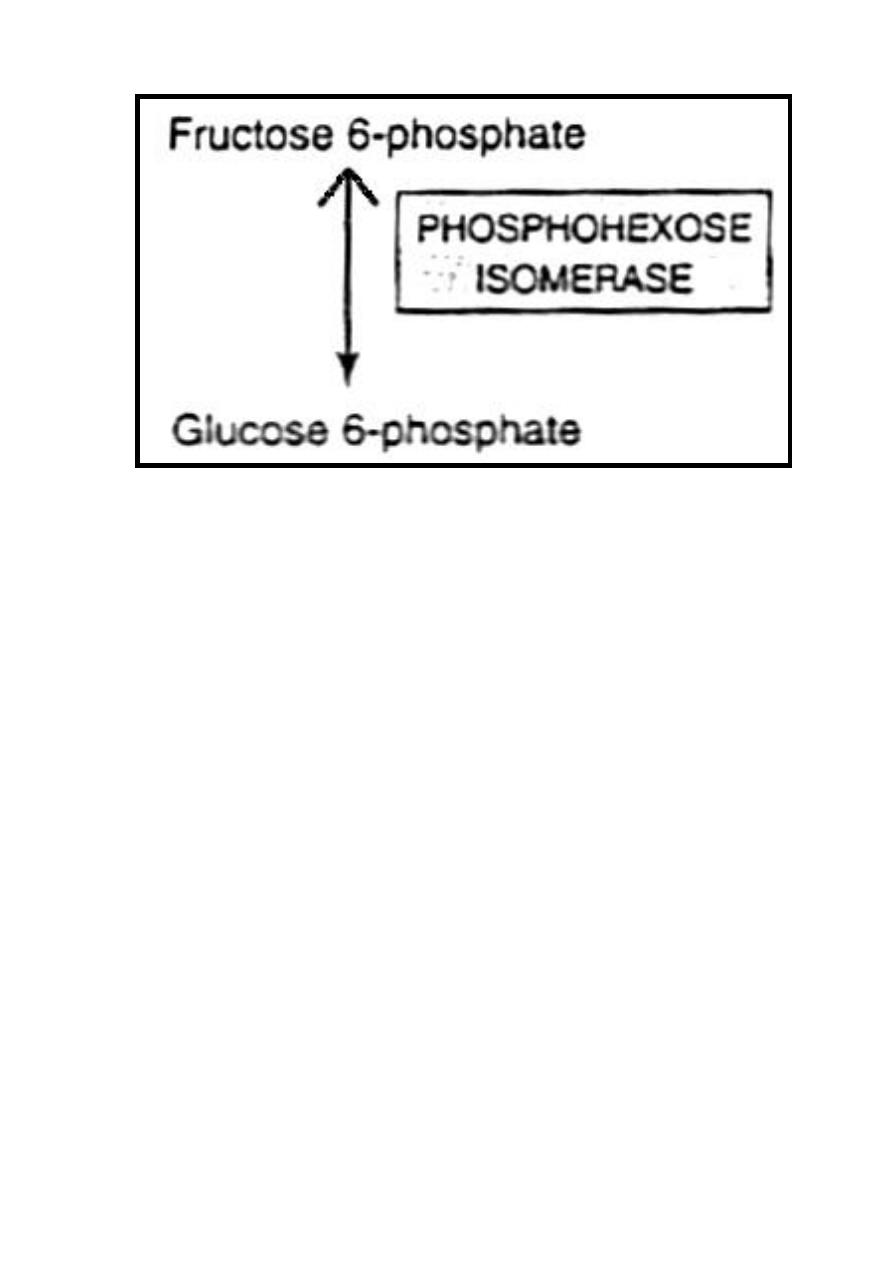
43
Although glucose 6-phosphate is common to both pentose
phosphate pathway & glycolysis, the pentose phosphate pathway
is markedly different from glycolysis by:-
1-Oxidation utilizes NADP rather than NAD.
2-CO
2
, which is not produced in glycolysis, is a characteristic
product of pentose phosphate pathway.
3- No ATP is generated in the pentose phosphate pathway,
whereas ATP is a major product of glycolysis.
44
45
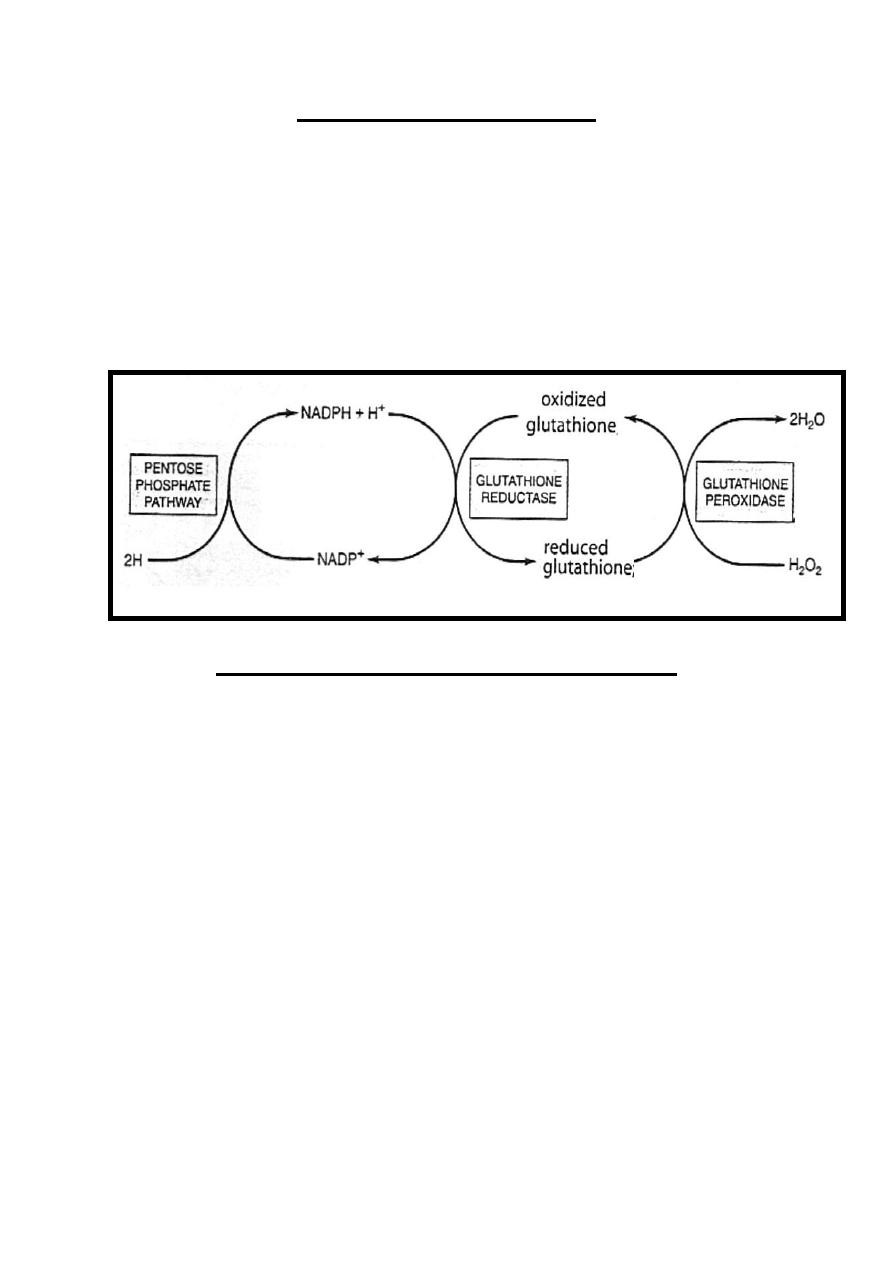
Reductive function of NADPH
The main reductive function of NADPH is found in
erythrocytes, in which NADPH +H
+
share in the reduction of
oxidized glutathione in a reaction catalyzed by glutathione
reductase enzyme.
The reduced glutathione remove H
2
O
2
in a reaction catalyzed by
glutathione peroxidase enzyme to be converted back into
oxidized form. This reaction is important, since H
2
O
2
decrease
the life span of the erythrocyte by causing oxidative damage to
the cell leading to hemolysis.
Clinical Aspect of Pentose Phosphate Pathway
Glucose-6-Phosphate Dehydrogenase Deficiency ((G6PD
Deficiency)) or Favism :- It’s the main clinical aspect of pentose
phosphate pathway in which there is a genetic deficiency of
glucose-6-phosphate dehydrogenase enzyme with consequent
impairment of the generation of NADPH + H
+
,this disease is
common in populations of Mediterranean & Afro-Caribbean
origin.
The defect is manifested as red cell hemolysis (hemolytic anemia)
when susceptible individuals are subjected to oxidants that
contains H
2
O
2
because glutathione peroxidase which remove
H
2
O
2
is dependent upon a supply of NADPH, which in
erythrocytes can be formed only via the pentose phosphate
pathway.
These oxidants that contains H
2
O
2
include mainly drugs as
primaquine, aspirin, sulfonamides or when they have eaten fava
beans[hence the term favism].

46
Uronic Acid Pathway
Uronic acid pathway is an alternative pathway for glucose
metabolism, but like the pentose pathway it does not lead to the
generation of ATP.
Uronic acid pathway catalyzes the conversion of glucose into
glucuronic acid, pentoses& in animal ascorbic acid.
-Glucuronic acid (glucuronate) is important in:
A-Incorporated into proteoglycans.
B- Steroid hormones, bilirubin & number of drugs are conjugated
with glucuronate to be excreted in urine or bile.
-Pentoses produced from uronic acid pathway mainly xylulose 5-
phosphate which enter the pentose phosphate pathway.
-Vitamin C is produced in animal from uronic acid pathway while
in human & other primates can not synthesized due to lack of
certain enzyme involved in this synthesis.
Metabolism of other hexoses
They include mainly fructose & galactose metabolism.
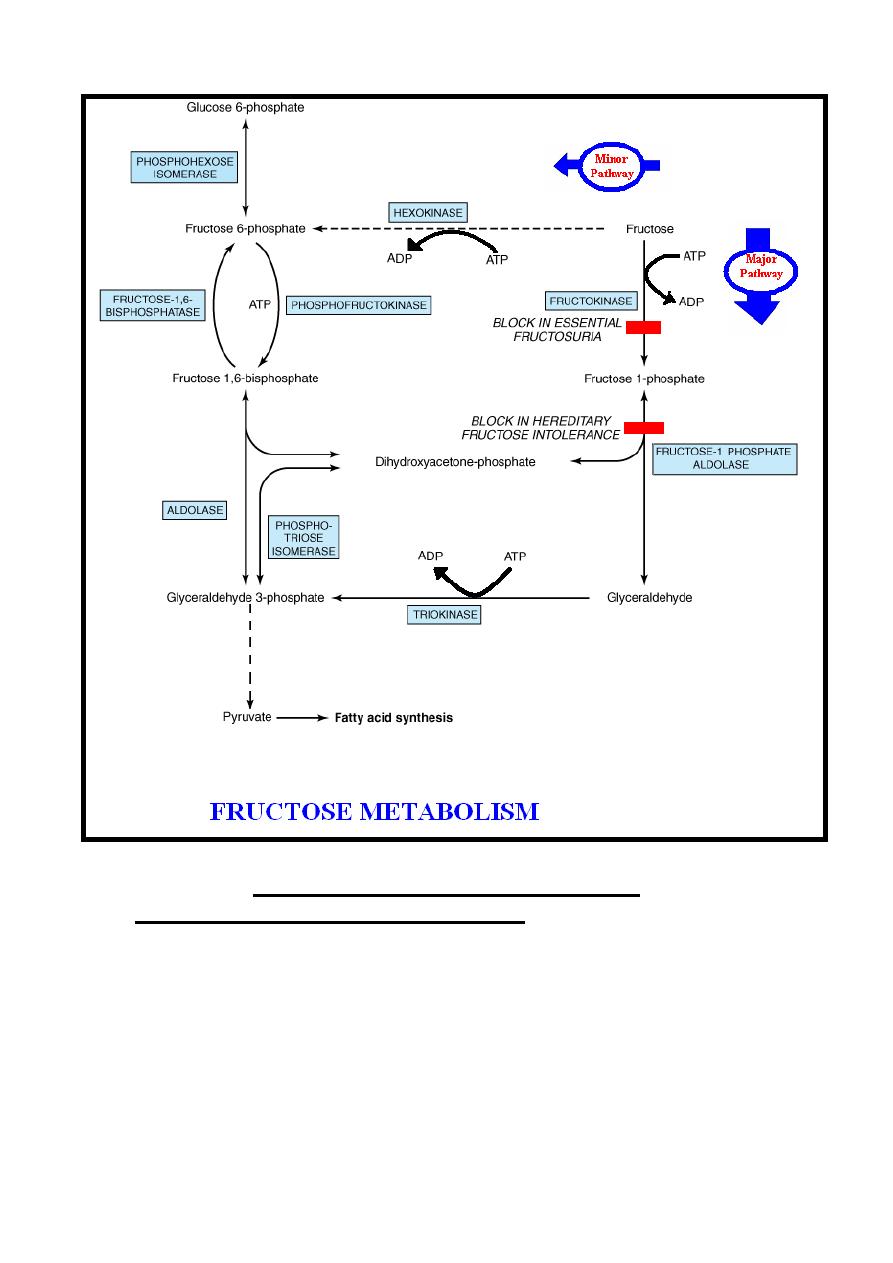
Fructose Metabolism
Fructose enters the liver from the small intestine through the
hepatic portal vein.
Inside the body ((mainly in the liver)) fructose is converted
mainly into glucose or to a less extent into the intermediates of
glycolysis & in minor amounts is converted into fatty acids
((increase in excess fructose intake)), this process occurs
through the following pathways:-
Major pathway: - It’s the main pathway for fructose
metabolism, it occurs in the liver & to less extent in the kidney
&intestine through the following steps:-
(1)- Pathway is initiated by a specific kinase enzyme present in
the liver & to less extent in the kidney &intestine known as
fructokinase, which catalyzes the irreversible phosphorylation
reaction of fructose to fructose 1-phosphate in the presence of ATP
which is converted into ADP. This enzyme (fructokinase) not acts
on glucose & unlike glucokinase; its activity is not affected by

47
fasting or by insulin, which may explain why fructose is cleared
from the blood of diabetics at a normal rate.
(2)-Fructose 1-phosphate is cleaved into glyceraldehyde &
dihydroxyacetone phosphate by reversible reaction catalyzed by
hepatic fructose 1-phosphate aldolase enzyme.
(3)-Phosphorylation of glyceraldehyde to glyceraldehyde 3-
phosphate by irreversible reaction catalyzed by triokinase enzyme
in the presence of ATP which is converted into ADP.
(4)-The two triose phosphates ((dihydroxyacetone phosphate &
glyceraldehyde 3-phosphate)), may be:-
A-Substrates for aldolase & hence gluconeogenesis, which is the
fate of much of the fructose metabolized in the liver.
B-Degraded by glycolysis.
Fructose undergoes more rapid glycolysis in the liver than does
glucose because it bypasses the regulatory step of glycolysis
catalyzed by phosphofructokinase enzyme.
Minor pathway: - In extrahepatic tissues, hexokinase enzyme
catalyzes the phosphorylation of fructose into fructose 6-
phosphate which enter glycolysis pathway. However, glucose
inhibits this phosphorylation of fructose since it’s a better
substrate for hexokinase; therefore, this pathway is consider as a
minor pathway.
Note:- Minor amount of pyruvate ((produced from the entering of
fructose metabolites into the glycolysis)) is converted into fatty acids,
this conversion is increase by excess fructose intake.
48
Clinical Aspects of Fructose Metabolism
1) - Loading of the liver with fructose: - as occur with
intravenous infusion or following very high fructose intakes, may
cause the followings:-
A-Hyperlipidemia because excess fructose in the liver
increases fatty acid synthesis & so VLDL secretion, leading to
increased LDL cholesterol which can be regarded as potentially
atherogenic.

49
B-Hyperuricemia because excess fructose intakes, causes
sequestration of inorganic phosphate in fructose 1-phosphate & so
diminished ATP. As a result there is less inhibition of denovo
purine synthesis by ATP & so uric acid formation is increased,
causing hyperuricemia, which is a cause of gout.
2)-Essential fructosuria: - Inborn error of metabolism due to
lack of hepatic fructokinase, the condition is benign.
3)-Hereditary fructose intolerance:- Inborn error of metabolism
due to absence of hepatic fructose 1-phosphate aldolase lead to the
following presentations that usually occur during infancy when
baby start to eat fructose containing diets.
A- Fructose-induced hypoglycemia because accumulation of
fructose 1-phosphate inhibits the activity of liver phosphorylase
causing hypoglycemia despite the presence of high glycogen
reserves, this especially evident after fructose administration.
B-Hyperuricemia because sequestration of inorganic phosphate
by the accumulated fructose 1-phosphate leads to depletion of
ATP ,therefore, there is less inhibition of denovo purine synthesis
by ATP & so uric acid formation is increased causing
hyperuricemia which is a cause of gout.
C-Liver impairment due to the accumulation of fructose 1-
phosphate in the liver.
D-Failure to thrive.
Diagnosis by detecting fructose in urine after administration of
fructose, more precise diagnosis by measurement of hepatic
fructose 1-phosphate aldolase activity.
Treatment by diets low in fructose, sorbitol & sucrose (because
they converted into fructose).
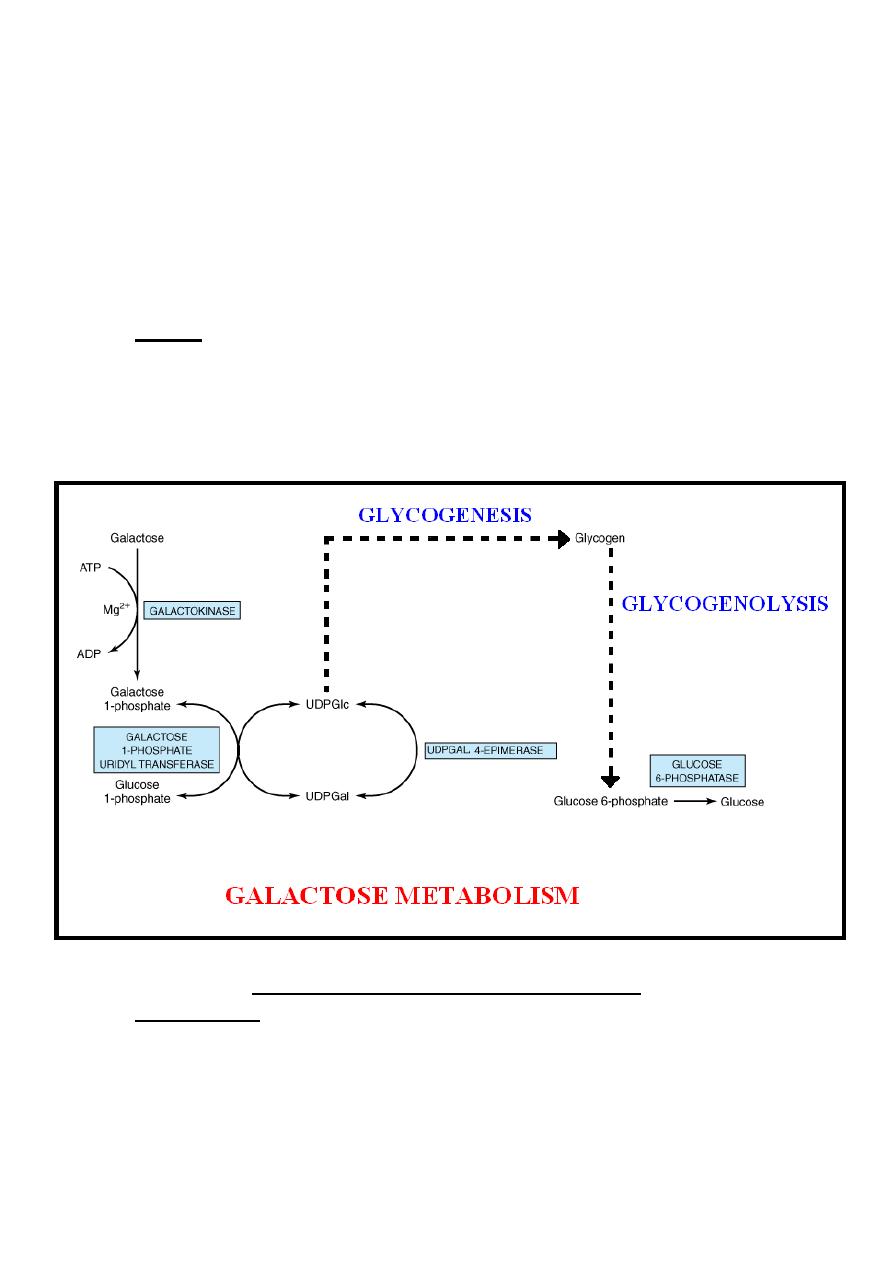
Galactose Metabolism
Galactose is derived from the intestinal hydrolysis of the
disaccharide known as lactose which is the sugar of milk. It’s
readily converted in the liver to glucose by the following steps:-
(1)-Galactose is phosphorylated to galactose 1-phosphate in the
presence of ATP which is converted into ADP in the irreversible
reaction catalyzed by galactokinase enzyme, this reaction need
magnesium ion as a cofactor.
50
(2)-Galactose 1-phosphate reacts with uridine diphosphate
glucose (UDPGlc) to form uridine diphosphate galactose
(UDPGal) & glucose 1-phosphate, in the reversible reaction
catalyzed by galactose 1-phosphate uridyl transferase enzyme.
(3)-The conversion of UDPGal to UDPGlc is by reversible
reaction catalyzed by UDPGal 4-epimerase enzyme.
(4)-Finally, glucose is liberated from UDPGlc after it enters the
glycogenesis pathway followed by the glycogenolysis.
Note:- Since the epimerase reaction is reversible. Therefore;
glucose can be converted to galactose, so that galactose is not a
dietary essential. However, galactose is required in the body not
only in the formation of lactose but also as a constituent of
glycolipids, proteoglycans & glycoproteins.
Clinical Aspect of Galactose Metabolism
Galactosemia: - Inborn error of metabolism characterize by the
inability to metabolize galactose , its caused mainly by inherited
defects of galactose 1-phosphate uridyl transferase & to less
extent by defect in galactokinase or UDPGal 4-epimerase, the
clinical features of galactosemia usually start to appear after the

51
baby start sucking milk which contain lactose, these clinical
features include mainly:-
1-Cataract:-The excess galactose concentration in the eye is
reduced to galacticol, which accumulates, causing cataract due to
its osmotic effect.
2-Failure to thrive.
3-Liver impairment:-especially in galactose 1-phosphate uridyl
transferase deficiency because of the accumulation of galactose 1-
phosphate in the liver.
4-Hypoglycemia.
Diagnosis by detection of galactose in urine.
Treatment by galactose-free diets. As the UDPGal 4-epimerase is
present in adequate amounts in most cases of galactosemia, the
galactosemic individual can still form UDPGal from glucose so
that normal growth & development can occur regardless of these
galactose-free diets.

52
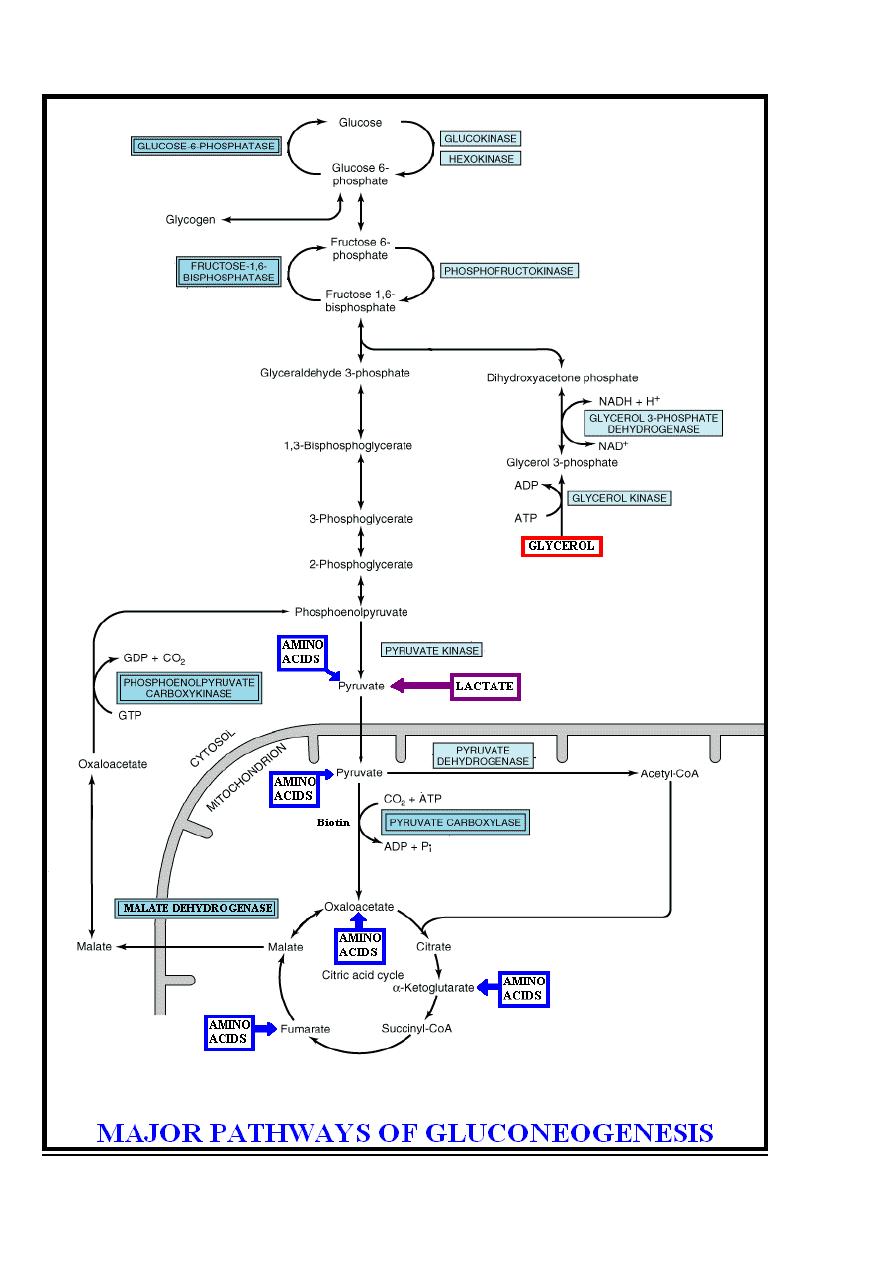
Gluconeogenesis
Gluconeogenesis is the term used to include all the pathways
responsible for converting noncarbohydrate precursors to glucose
or glycogen. These noncarbohydrate precursors include
glucogenic amino acids, lactate & glycerol.
Liver & kidney are the major gluconeogenic tissues.
Importance of gluconeogenesis
1-Meets the needs of the body for glucose which is important in
supplying energy especially for the nervous system& erythrocytes.
2- Clears lactate produced by the muscles & erythrocytes.
3- Clears glycerol produced by adipose tissue.
Therefore, failure of gluconeogenesis is usually fatal.
Pathways of gluconeogenesis
The pathway of gluconeogenesis involves reversal of glycolysis,
the citric acid cycle & some special reactions.
Three irreversible reactions of glycolysis ((catalyzed by
hexokinase, phosphofructokinase & pyruvate kinase enzymes))
prevent simple reversal of glycolysis for glucose syntheses by
gluconeogenesis.They are circumvented as follows:-
(1)- The conversion of pyruvate into phosphoenolpyruvate , to
achieve a reversal of glycolysis is through the following steps:
A)-Mitochondrial pyruvate carboxylase enzyme catalyzes the
carboxylation of pyruvate ((present in the mitochondria)) to
oxaloacetate, this irreversible reaction require ATP in the
presence of the vitamin biotin as a coenzyme.
B)-Oxaloacetate does not cross the mitochondrial inner
membrane; it should be converted to malate inside the
mitochondria by Krebs cycle in reaction catalyzed by malate
dehydrogenase enzyme, then malate is transported into the
cytosol & in the cytosol is converted back to oxaloacetate by
malate dehydrogenase enzyme.
C)-Phosphoenolpyruvate carboxykinase enzyme catalyzes the
decarboxylation & phosphorylation of oxaloacetate which present
in the cytoplasm to phosphoenolpyruvate ,this irreversible
53
reaction require GTP (Guanosine triphosphate) as the phosphate
donor which is converted into GDP (Guanosine diphosphate).
(2)-The conversion of fructose 1, 6-bisphosphate to fructose 6-
phosphate, to achieve a reversal of glycolysis, is catalyzed by
fructose- 1, 6-bisphosphatase enzyme which present in the
liver, kidney & skeletal muscle but is probably absent from heart
& smooth muscle.
(3)-The conversion of glucose 6-phosphate to glucose, to
achieve a reversal of glycolysis, is catalyzed by glucose-6-
phosphatase enzyme which present in the liver & kidney but
absent from muscle & adipose tissue, which, therefore, cannot
export glucose into the bloodstream.
Therefore by reversal of glycolysis & by citric acid cycle as
described above glucose can be formed from the following
noncarbohydrate precursors:-
1- Glucogenic amino acids after transamination or deamination
of these amino acids they yield either pyruvate or intermediates
of the citric acid cycle as α-ketoglutarate , oxaloacetate or
fumarate which enters the gluconeogenic pathway.
2-Lactate by a reaction catalyzed by lactate dehydrogenase
enzyme is converted into pyruvate which enters the
gluconeogenic pathway.
3-Glycerol which is converted into dihydroxyacetone phosphate
which enters gluconeogenesis through the reverse of glycolysis,
the conversion of glycerol into dihydroxyacetone phosphate
occurs through the following steps:-
Step 1:-Glycerol is released from adipose tissue as a result of
lipolysis & only tissues such as liver & kidney that possess
glycerol kinase enzyme that catalyzes the irreversible conversion
of glycerol to glycerol 3-phosphate in the presence of ATP which
is converted into ADP.
Glycerol kinase
Glycerol + ATP Glycerol 3-phosphate + ADP
Step 2:-Glycerol 3-phosphate is oxidized into dihydroxyacetone
phosphate by reversible reaction catalyzed by glycerol 3-

54
phosphate dehydrogenase enzyme in the presence of NAD
+
which is converted into NADH + H
+
.
Glycerol 3-phosphate + NAD
+
Glycerol 3-phosphate dehydrogenase
Dihydroxyacetone phosphate + NADH + H
+
Note: - Gluconeogenesis pathway requires energy which is
derived mainly from fatty acid oxidation.
55
56
Regulation of Gluconeogenesis
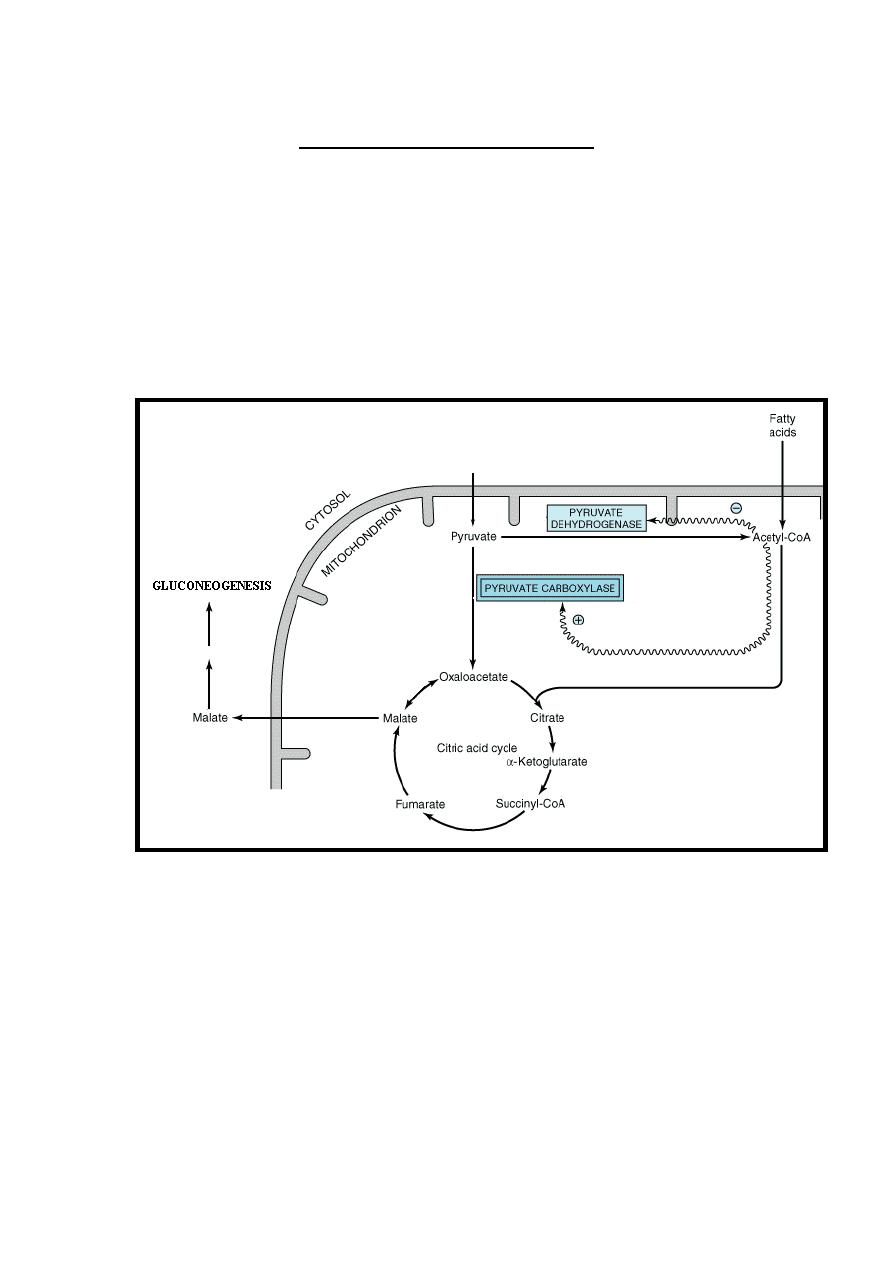
1-Pyruvate carboxylase enzyme in gluconeogenesis requires
acetyl-CoA as an activator & at the same time acetyl-CoA inhibit
pyruvate dehydrogenase complex which convert pyruvate into
acetyl-CoA to enter citric acid cycle.
Because acetyl-CoA is derived also from the oxidation of fatty
acids, this explains the action of fatty acid oxidation in sparing the
entering of pyruvate to the citric acid cycle & in stimulating
gluconeogenesis.
2-Fructose-2, 6-bisphosphate is most potent positive stimulator of
glycolysis ((through its stimulation of phosphofructokinase)) &
inhibitor of gluconeogenesis ((through its inhibition of fructose
1, 6 bisphosphatase)).
Fructose 2, 6-bisphosphate is formed by phosphorylation of
fructose 6-phosphate by phosphofructokinase-2 enzyme which
is under the positive control of fructose 6-phosphate
Therefore, when glucose is abundant it elevate the concentration
of fructose 6-phosphate which increase the concentration of

57
fructose 2, 6-bisphosphate ((stimulate glycolysis & inhibit
gluconeogenesis)) while when glucose is low the concentration of
fructose 6-phosphate & fructose 2, 6-bisphosphate is reduced lead
to stimulation of gluconeogenesis & inhibition of glycolysis.
3-Hormones that regulate gluconeogenesis acting through the
enzymes that control the irreversible reactions of gluconeogenesis,
these enzymes are pyruvate carboxylase, Phosphoenolpyruvate
carboxykinase, fructose- 1, 6-bisphosphatase& glucose-6-
phosphatase.
These hormones are the following:-
A-Glucocorticoids, glucagon & epinephrine stimulate
gluconeogenesis through their induction of the enzymes that control
the irreversible reactions of gluconeogenesis.
B-Insulin inhibits gluconeogenesis through its repression of the
enzymes that control the irreversible reactions of gluconeogenesis.
Hormonal Control of Carbohydrate Metabolism
1-Glycolysis is stimulated by insulin & is inhibited by glucagon &
epinephrine.
2-Glycogenesis is stimulated by insulin & is inhibited by glucagon
& epinephrine.
3-Glycogenolysis is stimulated by glucagon & epinephrine & is
inhibited by insulin.
4-Gluconeogenesis is stimulated by glucocorticoids, glucagon &
epinephrine & is inhibited by insulin.
Blood Glucose Level
The concentration of blood glucose is regulated within narrow limits
ranging from 3.3 mmol/L ((60 mg/dL)) in starvation up to 7.2
mmol/L ((130 mg/dL)) after the ingestion of a carbohydrate meal.
A sudden decrease in blood glucose will cause convulsions due to
the immediate brain dependence on a supply of glucose.
However, much lower concentration can be tolerated, provided
progressive adaptation is allowed by gluconeogenesis & ketone
bodies formation.

58
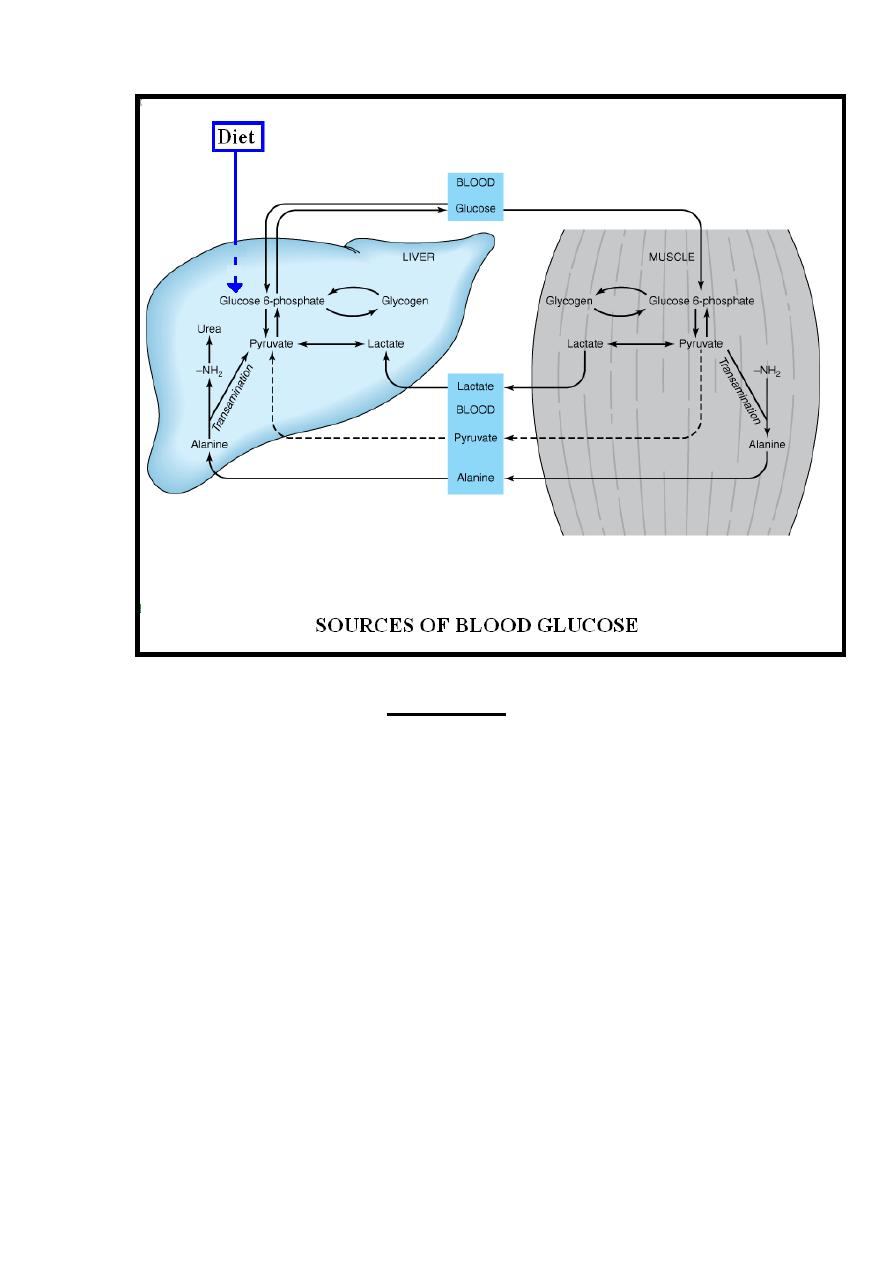
Sources of Blood Glucose
I ))-Diet:-
The digestible dietary carbohydrates yield glucose,
galactose& fructose that are transported to the liver via the
hepatic portal vein. Galactose & fructose are readily converted
to glucose in the liver .
II ))-Gluconeogenesis:-
glucose is formed from the following
two groups of compounds that undergo gluconeogenesis .
(A) Compounds that involved a direct conversion to glucose
within the liver including most of glucogenic amino acids &
glycerol.
(B) Compounds which are the products of the metabolism of
glucose in the tissues as lactate & the amino acid alanine
through the following cycles:
1-Lactic Acid (Cori) Cycle:- Lactate which formed by the
glycolysis in the skeletal muscles & erythrocytes, is transported
to the liver & kidney via circulation where it reforms glucose by
gluconeogenesis, this formed glucose reach skeletal muscle &
erythrocytes through the circulation again to become available for
glycolysis & so on the cycle continue again. This process is
known as the Cori cycle or lactic acid cycle.
2- Glucose-Alanine Cycle:- Most important amino acid
transported via circulation from skeletal muscle to the liver
during fasting state is alanine which forms by transamination of
pyruvate. In the liver alanine is converted into glucose by
gluconeogenesis, this formed glucose reach skeletal muscle
through the circulation again to become available for glycolysis &
alanine formation so that the cycle continue again. This process is
known as the glucose-alanine cycle.
III ))-Glycogenolysis:- Another source of blood glucose is from
glycogenolysis of the liver glycogen.
59
Glucosuria
Normally glucose is continuously filtered by the glomeruli but its
completely reabsorbed in the renal tubules; therefore, normally
there is no glucose in urine. This happen when venous blood
glucose concentration is below the renal threshold for glucose
{171-180 mg/dl (9.5-10.0 mmol/L) }
The presence of glucose in urine (glucosuria) suggest:
1-Hyperglycemia when venous blood glucose concentration
exceeds the renal threshold for glucose as occurs in diabetes
mellitus.
2- Reduction of renal threshold for glucose as occurs in:
A-Renal glucosuria which is harmless condition with no obvious
cause for it.
B-During pregnancy which is due to hypervolemia that occur during
pregnancy.

60
Diabetes Mellitus
Diabetes mellitus is a family of disorders that is characterized by
hyperglycemia. The disorders of diabetes differ in their etiology
, symptoms & in the consequences of disease.
In Mosul, more than 10% of the population suffers from
diabetes.
Classification of Diabetes Mellitus
Diabetes have been classified into four forms which are:-
-Type 1 diabetes mellitus.
-Type 2 diabetes mellitus.
-Gestational diabetes mellitus.
-Other specific types of diabetes mellitus.
Type1 Diabetes Mellitus
Type 1 diabetes usually represents about 5-10% of diabetes &
it is due to lack of insulin production & secretion by the beta
cells of the pancreas.
Type1diabetes manifests itself usually during childhood &
adolescents.
Treatment by insulin replacement, diet management & exercise .
Type1diabetes is subclassified into:-
A-Immune mediated : represent the common form of type 1
diabetes in which there is an autoimmune destruction of the beta
cells of the pancreas by autoantibodies leading to absolute
insulin deficiency.
There is a genetic susceptibility for the development of these
autoantibodies,
with
certain
histocompatibility
antigens
predominant (HLA-DR3 &DR4) . However, the development of
disease is complex; triggering factors, such as rubella, mumps,
& other viral infection & chemical contact may be necessary for
progression of disease.
B-Idiopathic: represent the rare form of type 1 diabetes in
which there is no any obvious cause for the development of
disease.

61
Type 2 Diabetes Mellitus
It forms the most common type of diabetes
& it is either due to
the body does not produce enough insulin or reduction of
cellular
effects of insulin ((insulin resistance)).
The etiology of type 2 diabetes is
polygenic which means that
both hereditary & environmental factors(
obesity, lack of
physical activity & certain racial groups)
are important for its
appearance.
Other factors important in the development of disease are
previous history of gestational diabetes, increasing age,
dyslipidemia & hypertension.
Type 2 diabetes usually affects obese people older than 40
years.
Treatment usually by weight reduction, diet management & oral
hypoglycemic drugs. Insulin may be prescribed for type 2
diabetics who fail to achieve glycemic control with other
measures.
Gestational Diabetes Mellitus (GDM)
It’s defined as diabetes that is diagnosed first time during
pregnancy , it affects about 4% of all pregnant women.
During pregnancy there is
reduction of cellular effects of insulin
((insulin resistance))
. Most pregnant women will compensate
with increased secretion of insulin; those individuals who are
unable to compensate may develop gestational diabetes .
The hyperglycemia of gestational diabetes diminishes after
delivery; however, the individual who has developed gestational
diabetes is at higher risk for the development of type 2 diabetes
thereafter
specially those showing autoantibodies at the time of
delivery
.
Other Specific Types of Diabetes
It’s previously called secondary diabetes. These specific types
include mainly:-
TABLE 4-1
-Genetic defects of beta cell function.
-Genetic defects in insulin action.
-Diseases of the exocrine pancreas such as cystic fibrosis.
-Endocrinopathies such as Cushing’s syndrome.

62
-Drug or chemical-induced such as glucocorticoids.
-Infections.
-Uncommon forms of immune-mediated diabetes.
Impaired Glucose Tolerance
(Impaired Fasting Glucose, Prediabetes)
Impaired glucose tolerance represents a blood glucose levels
are higher than normal but not high enough to be characterized
as overt diabetes (borderline stage). Persons with impaired
glucose tolerance have a higher risk for macroangiopathy & the
cardiovascular mortality than those with normal person.
20-30% of people with impaired glucose tolerance will develop
clinically overt diabetes mellitus within 10 years. Therefore,
persons with impaired glucose tolerance need follow-up &
weight reduction.
Diagnosis of Diabetes Mellitus
Usually by measuring plasma glucose as follow:-
1-Fasting plasma glucose test:- Measures plasma glucose after
at least 8 hours without eating. This test is used to detect
diabetes or pre-diabetes as follow:-
Fasting Plasma Glucose Result (mg/dL)
Diagnosis
70-99
Normal
100 to 125
Pre-diabetes
(impaired fasting glucose)
126 and above
Diabetes
2-Oral glucose tolerance test (OGTT):- Measures plasma
glucose after at least 8 hours without eating & 2 hours after
drink a liquid containing 75 gm glucose. This test is more
precise in diagnose diabetes or especially pre-diabetes as
follow:-
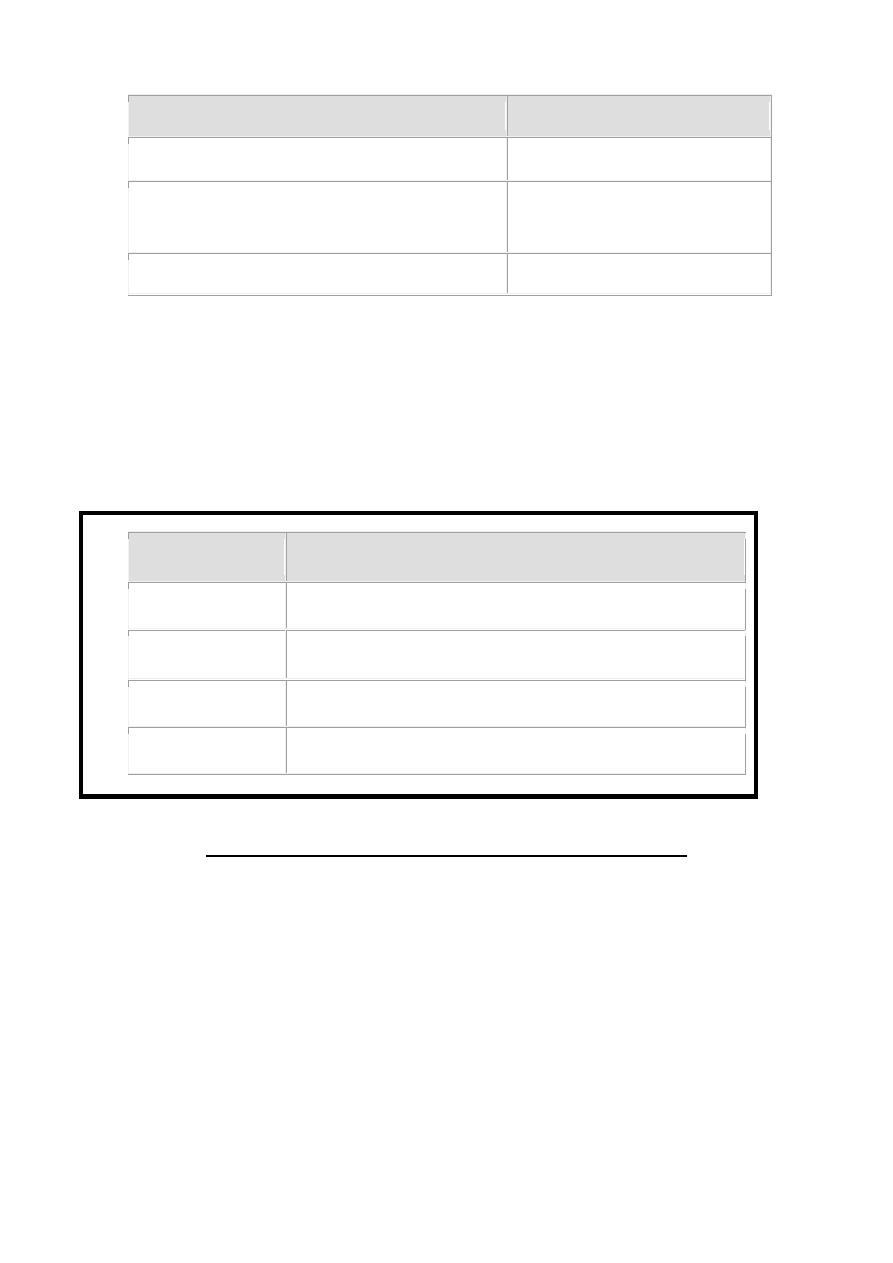
63
2-Hour Plasma Glucose Result (mg/dL)
Diagnosis
139 and below
Normal
140 to 199
Pre-diabetes
(impaired glucose tolerance)
200 and above
Diabetes
In gestational diabetes it’s diagnosed by a special form of OGTT
in which measures plasma glucose after at least 8 hours without
eating then we measures plasma glucose 1 hour , 2 hours & 3
hours after drink a liquid containing 100 gm glucose. If plasma
glucose levels in at least two of four reading reach the value
found in following table, it means that the pregnant women have
gestational diabetes.
When
Plasma Glucose Result (mg/dL)
Fasting
95 or higher
At 1 hour
180 or higher
At 2 hours
155 or higher
At 3 hours
140 or higher
Long Term Complications of Diabetes Mellitus
1- Microangiopathy resulting in the development of retinopathy,
nephropathy & neuropathy.
2-
Macroangiopathy r
esulting in atherosclerosis & coronary
heart disease.
