
9/28/2012
1
Chemistry:
The Study of Change
Chapter 1
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Chemistry: A Science for the 21
st
Century
• Health and Medicine
• Sanitation systems
• Surgery with anesthesia
• Vaccines and antibiotics
•Energy and the Environment
• Fossil fuels
• Solar energy
• Nuclear energy
1.1
Chemistry: A Science for the 21
st
Century
• Materials and Technology
• Polymers, ceramics, liquid crystals
• Room-temperature superconductors?
• Molecular computing?
• Food and Agriculture
• Genetically modified crops
• “Natural” pesticides
• Specialized fertilizers
1.1
1.2
The Study of Chemistry
Macroscopic
Microscopic
The scientific method is a systematic
approach to research
1.3
A hypothesis is a tentative explanation for a
set of observations
tested modified
A theory is a unifying principle that explains
a body of facts and/or those laws that are
based on them.
1.3
A law is a concise statement of a relationship
between phenomena that is always the same
under the same conditions.
Atomic Theory
Force = mass x acceleration

9/28/2012
2
Chemistry In Action:
In 1940 George Gamow hypothesized that
the universe began with a gigantic explosion
or big bang.
Experimental Support
• expanding universe
• cosmic background radiation
• primordial helium
1.3
Primordial Helium and the Big Bang Theory
1.
Matter is anything that occupies space and
has mass.
2. A substance is a form of matter that has a
definite composition and distinct properties.
Chemistry is the study of matter and the
changes it undergoes
1.4
Sugar
Water
Gold
A mixture is a combination of two or more substances
in which the substances retain their distinct identities.
1. Homogenous mixture
– composition of the
mixture is the same throughout.
2. Heterogeneous mixture
– composition is not
uniform throughout.
soft drink, milk
cement,
iron filings in sand
1.4
Physical means can be used to separate a mixture
into its pure components.
magnet
1.4
distillation
An element is a substance that
cannot
be
separated into simpler substances by chemical
means.
•
114 elements have been identified
• 82 elements occur naturally on Earth
gold, aluminum, lead, oxygen, carbon
• 32 elements have been created by scientists
technetium, americium, seaborgium
1.4

9/28/2012
3
A compound is a substance composed of atoms
of two or more elements chemically united in fixed
proportions.
Compounds can only be separated into their
pure components (elements) by chemical
means.
1.4
Water (H
2
O)
Glucose (C
6
H
12
O
6
)
Ammonia (NH
3
)
1.4
Classifications of Matter
The Three States of Matter
1.5
solid
liquid
gas
A physical change does not alter the composition
or identity of a substance.
A chemical change alters the composition or
identity of the substance(s) involved.
ice melting
sugar dissolving
in water
1.6
hydrogen burns in
air to form water
Physical or Chemical?
An extensive property of a material depends upon
how much matter is is being considered.
An intensive property of a material
does not
depend upon how much matter is is being
considered.
• mass
• length
• volume
• density
• temperature
• color
Extensive and Intensive Properties
1.6
Matter - anything that occupies space and has mass.
mass
– measure of the quantity of matter
SI unit of mass is the kilogram (kg)
1 kg = 1000 g = 1 x 10
3
g
weight
– force that gravity exerts on an object
weight = c x mass
on earth, c = 1.0
on moon, c ~ 0.1
1.7
A 1 kg bar will weigh
1 kg on earth
0.1 kg on moon
9/28/2012
4
1.7
International System of Units (SI)
1.7
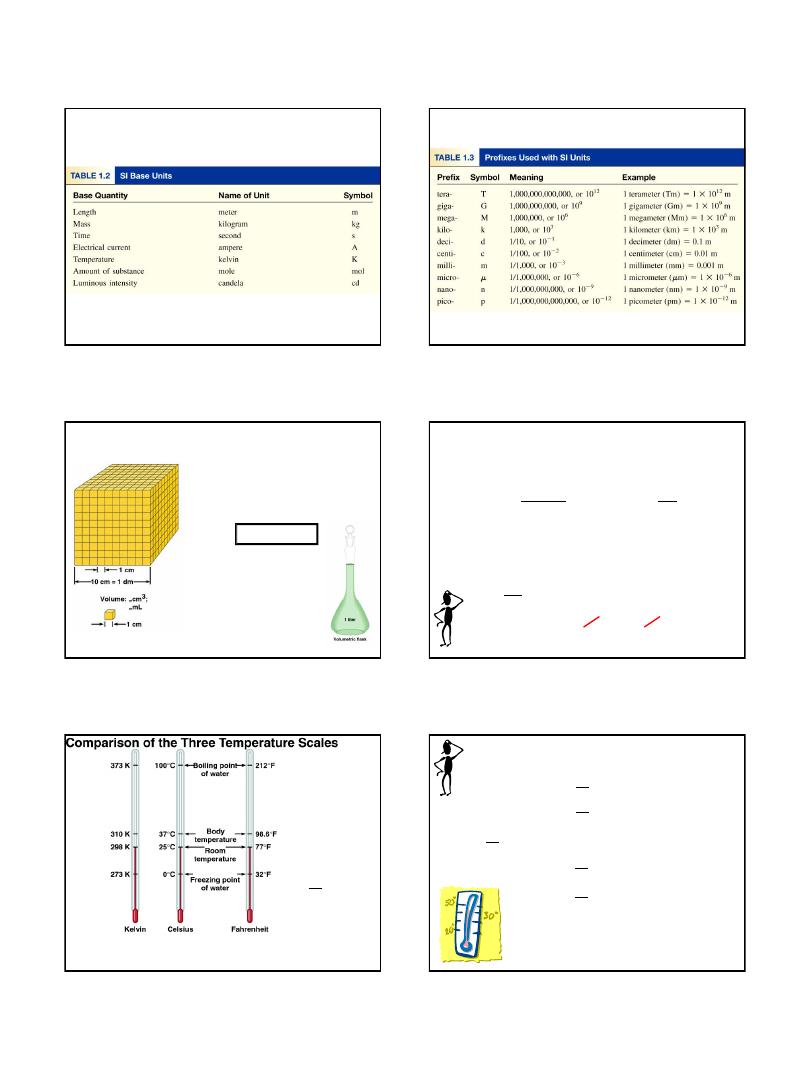
Volume
– SI derived unit for volume is cubic meter (m
3
)
1 cm
3
= (1 x 10
-2
m)
3
= 1 x 10
-6
m
3
1 dm
3
= (1 x 10
-1
m)
3
= 1 x 10
-3
m
3
1 L = 1000 mL = 1000 cm
3
= 1 dm
3
1 mL = 1 cm
3
1.7
Density
– SI derived unit for density is kg/m
3
1 g/cm
3
= 1 g/mL = 1000 kg/m
3
density =
mass
volume
d =
m
V
1.7
A piece of platinum metal with a density of 21.5
g/cm
3
has a volume of 4.49 cm
3
. What is its mass?
d =
m
V
m = d x V = 21.5 g/cm
3
x 4.49 cm
3
= 96.5 g
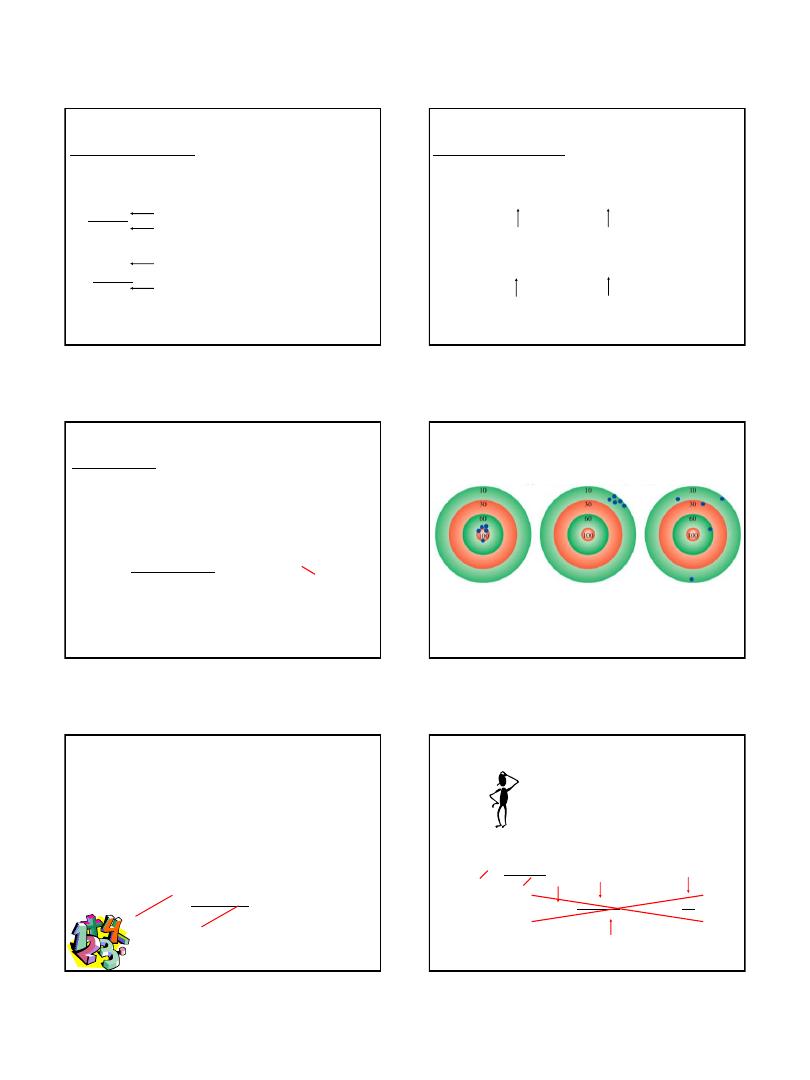
K =
0
C + 273.15
0
F = x
0
C + 32
9
5
1.7
273 K = 0
0
C
373 K = 100
0
C
32
0
F = 0
0
C
212
0
F = 100
0
C
Convert 172.9
0
F to degrees Celsius.
0
F = x
0
C + 32
9
5
0
F
– 32 = x
0
C
9
5
x (
0
F
– 32) =
0
C
9
5
0
C = x (
0
F
– 32)
9
5
0
C = x (172.9
– 32) = 78.3
9
5
1.7

9/28/2012
5
Chemistry In Action
On 9/23/99, $125,000,000 Mars Climate Orbiter entered Mar’s
atmosphere 100 km (62 miles) lower than planned and was
destroyed by heat.
1.7
1 lb = 1 N
1 lb = 4.45 N
“This is going to be the
cautionary tale that will be
embedded into introduction
to the metric system in
elementary school, high
school, and college science
courses till the end of time.”
1.8
Scientific Notation
The number of atoms in 12 g of carbon:
602,200,000,000,000,000,000,000
6.022 x 10
23
The mass of a single carbon atom in grams:
0.0000000000000000000000199
1.99 x 10
-23
N x 10
n
N is a number
between 1 and 10
n is a positive or
negative integer
Scientific Notation
1.8
568.762
n > 0
568.762 = 5.68762 x 10
2
move decimal left
0.00000772
n < 0
0.00000772 = 7.72 x 10
-6
move decimal right
Addition or Subtraction
1. Write each quantity with
the same exponent
n
2. Combine N
1
and N
2
3. The exponent,
n
, remains
the same
4.31 x 10
4
+ 3.9 x 10
3
=
4.31 x 10
4
+ 0.39 x 10
4
=
4.70 x 10
4
Scientific Notation
1.8
Multiplication
1. Multiply N
1
and N
2
2. Add exponents n
1
and n
2
(4.0 x 10
-5
) x (7.0 x 10
3
) =
(4.0 x 7.0) x (10
-5
+
3
) =
28 x 10
-2
=
2.8 x 10
-1
Division
1. Divide N
1
and N
2
2. Subtract exponents n
1
and n
2
8.5 x 10
4
÷ 5.0 x 10
9
=
(8.5
÷ 5.0) x 10
4
-
9
=
1.7 x 10
-5
Significant Figures
1.8
• Any digit that is not zero is significant
1.234 kg
4
significant figures
• Zeros between nonzero digits are significant
606 m
3
significant figures
• Zeros to the left of the first nonzero digit are not significant
0.08 L
1
significant figure
• If a number is greater than 1, then all zeros to the right of the
decimal point are significant
2.0 mg
2
significant figures
• If a number is less than 1, then only the zeros that are at the
end and in the middle of the number are significant
0.00420 g
3
significant figures
How many significant figures are in
each of the following measurements?
24 mL
2 significant figures
3001 g
4 significant figures
0.0320 m
3
3 significant figures
6.4 x 10
4
molecules
2 significant figures
560 kg
2 significant figures
1.8
9/28/2012
6
Significant Figures
1.8
Addition or Subtraction
The answer cannot have more digits to the right of the decimal
point than any of the original numbers.
89.332
1.1
+
90.432
round off to 90.4
one significant figure after decimal point
3.70
-2.9133
0.7867
two significant figures after decimal point
round off to 0.79
Significant Figures
1.8
Multiplication or Division
The number of significant figures in the result is set by the original
number that has the smallest number of significant figures
4.51 x 3.6666 = 16.536366 = 16.5
3 sig figs
round to
3 sig figs
6.8
÷ 112.04 = 0.0606926
2 sig figs
round to
2 sig figs
= 0.061
Significant Figures
1.8
Exact Numbers
Numbers from definitions or numbers of objects are considered
to have an infinite number of significant figures
The average of three measured lengths; 6.64, 6.68 and 6.70?
6.64 + 6.68 + 6.70
3
= 6.67333 = 6.67
Because 3 is an exact number
= 7
Accuracy
– how close a measurement is to the true value
Precision
– how close a set of measurements are to each other
accurate
&
precise
precise
but
not
accurate
not
accurate
&
not
precise
1.8
1.9
Dimensional Analysis Method of Solving Problems
1. Determine which unit conversion factor(s) are needed
2. Carry units through calculation
3. If all units cancel except for the desired unit(s), then the
problem was solved correctly.
given quantity x conversion factor = desired quantity
given unit x
= desired unit
desired unit
given unit
1.9
Dimensional Analysis Method of Solving Problems
Conversion Unit 1 L = 1000 mL
1L
1000 mL
1.63 L x
= 1630 mL
1L
1000 mL
1.63 L x
= 0.001630
L
2
mL
How many mL are in 1.63 L?

9/28/2012
7
The speed of sound in air is about 343 m/s. What is
this speed in miles per hour?
1 mi = 1609 m
1 min = 60 s
1 hour = 60 min
343
m
s
x
1 mi
1609 m
60 s
1 min
x
60 min
1 hour
x
= 767
mi
hour
meters to miles
seconds to hours
1.9
conversion units
