
Body fluid compartments
Objectives: By the end of this lecture, you will be able to:
- Describe the daily water intake and loss by the human
body.
- Define body fluid compartments.
- List the important constituents of extracellular and
intracellular compartments.
- Outline the regulation of fluid exchange and osmotic
equilibrium between extracellular and intracellular fluid.
- Describe the volume and osmolality of Extracellular and
Intracellular Fluids in abnormal States.
- Outline the fluids used in clinical practice.
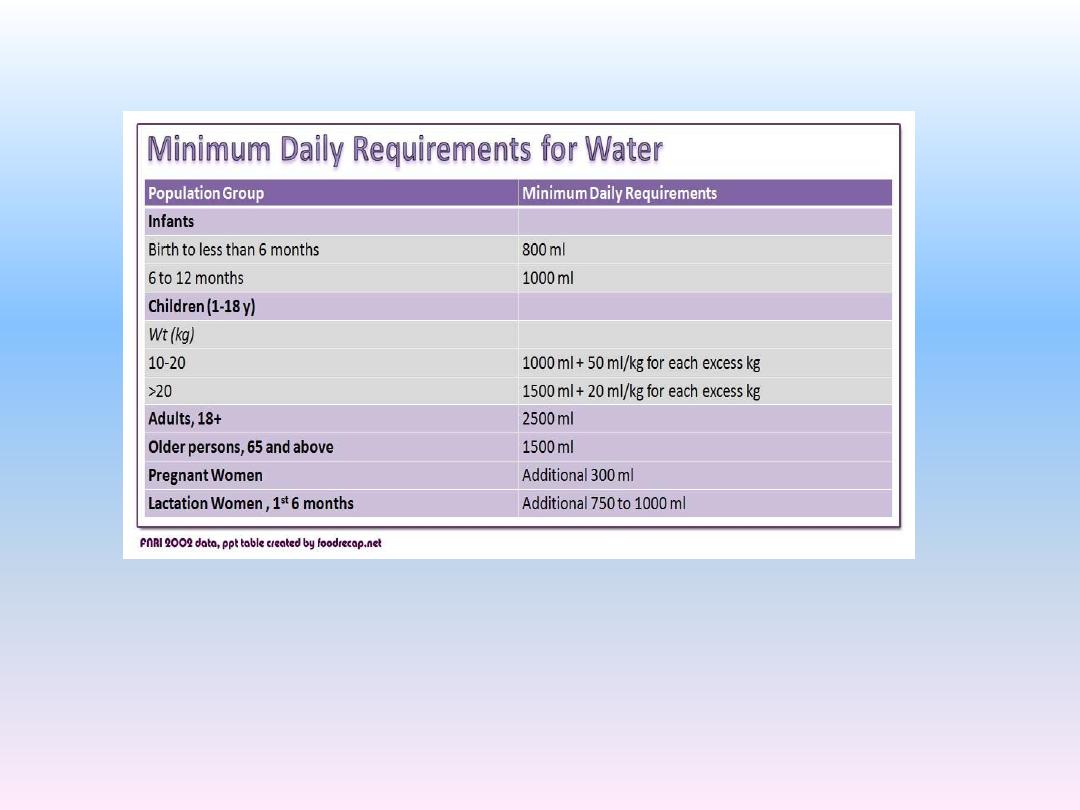
1. It is ingested in the form of liquids or water in the food, which
together normally add about 2100 ml/day to the body fluids.
2. It is synthesized in the body as a result of oxidation of
carbohydrates, adding about 200 ml/day.
This provides a total water intake of about 2300 ml/day.
Daily Intake of Water
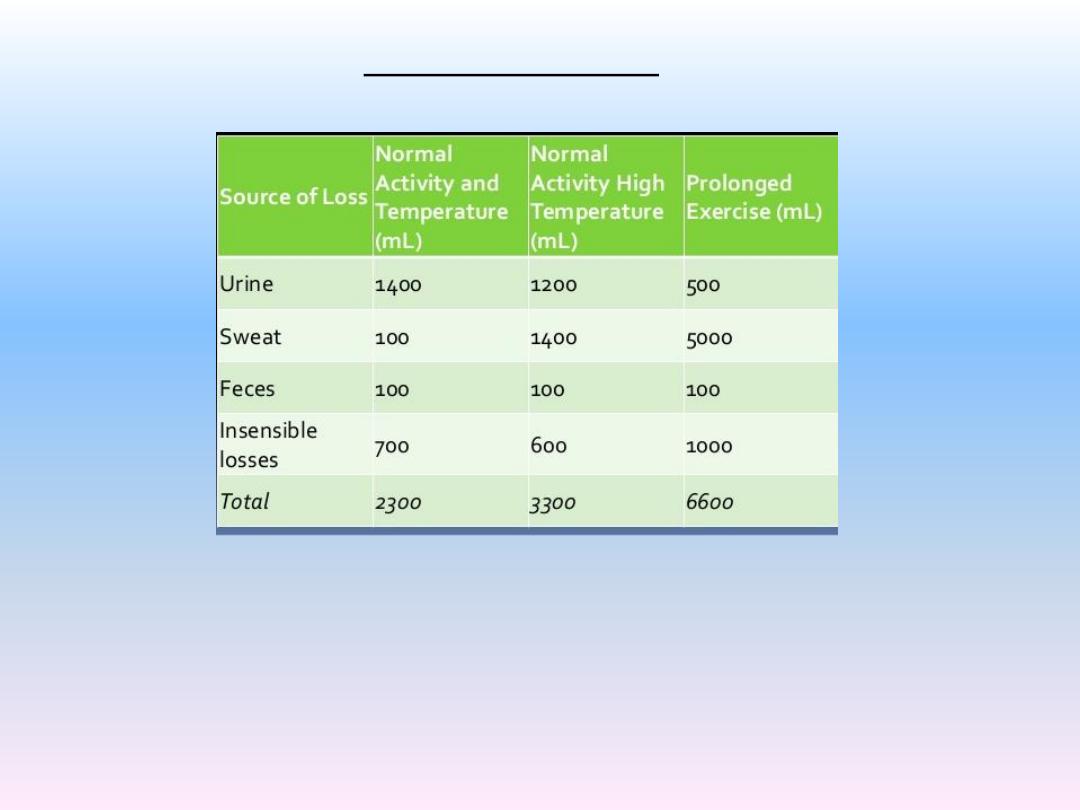
Insensible water loss about 700 ml/day by diffusion through the skin is about 300
to 400 ml/day and through respiratory tract about 300 to 400 ml/day.
Daily Loss of Body Water

Total amount of fluid in the human body is approximately 70% of
body weight
Body fluid has been divided into two compartments
–
Intracellular fluid (ICF)
Inside the cells
55% of total body water
Extracellular fluid
Outside the cells
45% of total body water

Body Fluid Compartments
Extracellular fluid includes
• Interstitial fluid
»
Present between the cells
»
Approximately 80% of ECF
• Plasma
»
Present in blood
»
Approximately 20% of ECF
• Also includes
»
Lymph
»
synovial fluid
»
aqueous humor
»
cerebrospinal fluid
vitreous body,
endolymph,
perilymph,
pleural, pericardial
and peritoneal fluids

Blood Volume
Blood contains both extracellular fluid (the fluid in plasma)
and intracellular fluid (the fluid in the red blood cells).
The average blood volume of adults is about 7 per cent of
body weight, or about 5 liters. About 60 per cent of the blood
is plasma and 40 per cent is red blood cells.
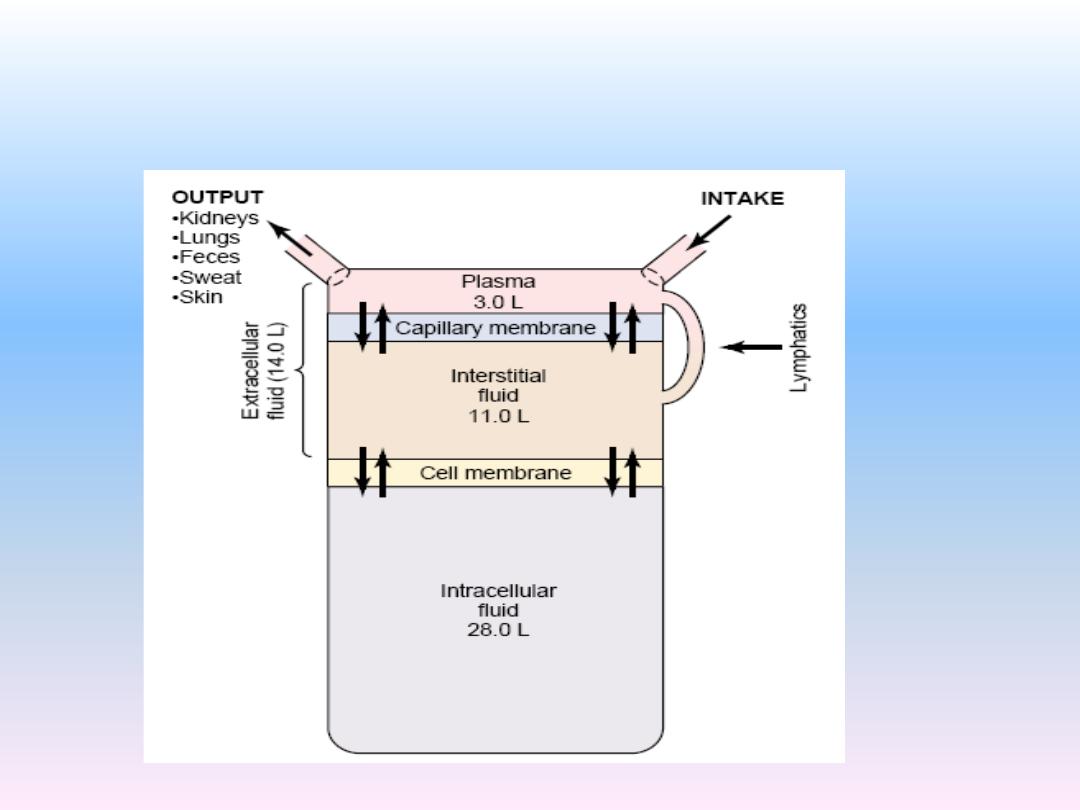
Water exchange throught the body

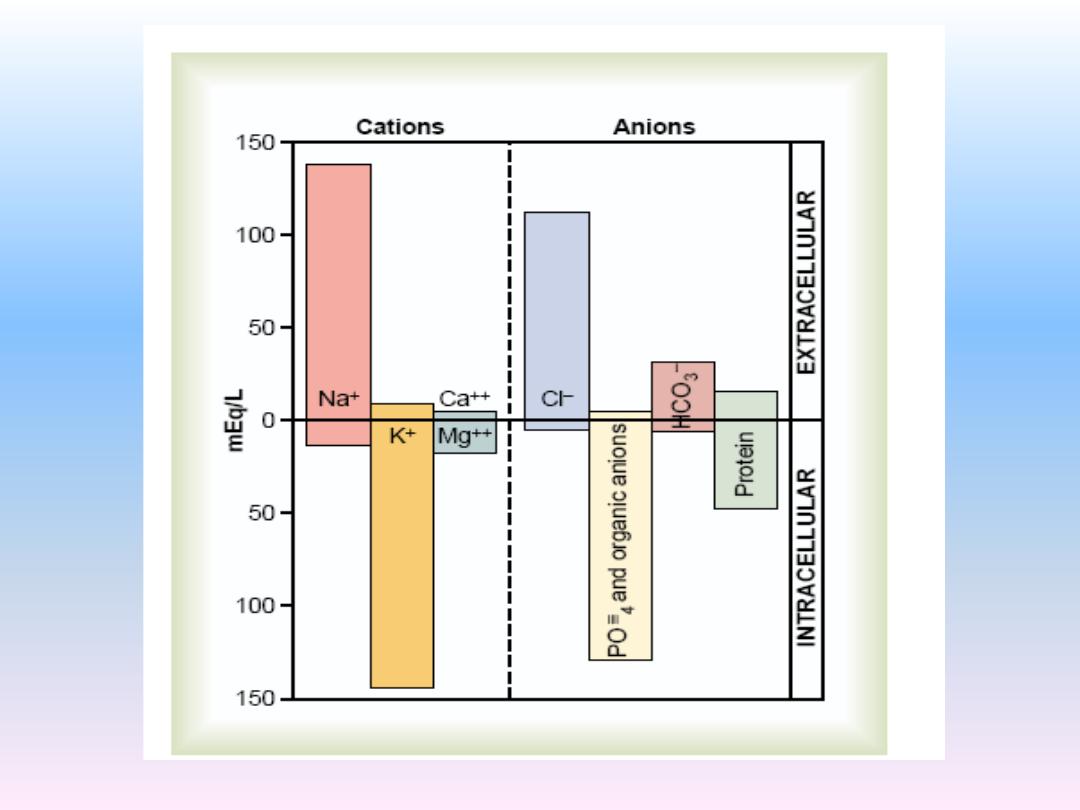
Important constituents Of Extracellular fluid:
The extracellular fluid, including the plasma and the
interstitial fluid, contains large amounts of sodium and
chloride ions, reasonably large amounts of bicarbonate
ions, but only small quantities of potassium, calcium,
magnesium, phosphate, and organic acid ions.
This allows the cells to remain continually bathed in a
fluid that contains the proper concentration of electrolytes
and nutrients for optimal cell function.

Important Constituents of the Intracellular Fluid
The intracellular fluid is separated from the extracellular
fluid by a cell membrane that is highly permeable to
water but not to most of the electrolytes in the body. In
contrast to the extracellular fluid, the intracellular fluid
contains ions large amounts of potassium and
phosphate ions plus moderate quantities of magnesium
and sulfate ions. Also, cells contain large amounts of
protein, almost four times as much as in the plasma.
only small quantities of sodium and chloride ions and
almost no calcium

Basic Principles of Osmosis and Osmotic Pressure
Osmosis is the net diffusion of water across a selectively
permeable membrane from a region of high water
concentration to one that has a lower water
concentration.

whenever there is a higher concentration of solute on
one side of the cell membrane, water diffuses across
the membrane toward the region of higher solute
concentration.
Thus, if a solute such as sodium chloride is added to the
extracellular fluid, water rapidly diffuses from the cells
through the cell membranes into the extracellular fluid
until the water concentration on both sides of the
membrane becomes equal.
Conversely, if a solute such as sodium chloride is
removed from the extracellular fluid, water diffuses from
the extracellular fluid through the cell membranes and
into the cells.

Relation Between Moles and Osmoles.
the water concentration of a solution depends on the number of
solute particles in the solution.
The total number of particles in a solution is measured in
osmoles.
One osmole (osm) is equal to 1 mole (mol) (6.02 × 10
23
) of
solute particles.
a solution containing 1 mole of glucose in each liter has a
concentration of 1 osm/L.
Thus, the term osmole refers to the number of osmotically
active particles in a solution rather than to the molar
concentration.
The term milliosmole (mOsm), which equals 1/1000 osmole, is
commonly used.

Osmolality and Osmolarity.
The osmolal concentration of a solution is called
osmolality when the concentration is expressed
as osmoles per kilogram of water;
it is called osmolarity when it is expressed as
osmoles per liter of solution.

Osmotic Pressure.
Osmosis of water molecules across a selectively
permeable membrane can be opposed by applying a
pressure in the direction opposite that of the osmosis.
The precise amount of pressure required to prevent
the osmosis is called the osmotic pressure.
The higher the osmotic pressure of a solution, the
lower the water concentration and the higher the
solute concentration of the solution.

Relation Between Osmotic Pressure and Osmolarity.
The osmotic pressure of a solution is directly proportional to
the concentration of osmotically active particles in that
solution.
For example, one molecule of albumin with a molecular
weight of 70,000 has the same osmotic effect as one
molecule of glucose with a molecular weight of 180.
One molecule of sodium chloride, however, has two
osmotically active particles,Na+ and Cl
–, and therefore has
twice the osmotic effect of either an albumin molecule or a
glucose molecule.
the osmotic pressure of a solution is proportional to its
osmolarity.
for each milliosmole concentration gradient across the cell
membrane, 19.3 mm Hg osmotic pressure is exerted.

Osmolarity of the Body Fluids.
the total osmolarity of each of the three compartments is
about 300 mOsm/L, with the plasma being about 1
mOsm/L greater than that of the interstitial and intracellular
fluids. The slight difference between plasma and interstitial
fluid is caused by the osmotic effects of the plasma
proteins, which maintain about 20 mm Hg greater pressure
in the capillaries than in the surrounding interstitial spaces.
Osmotic Equilibrium Is Maintained Between Intracellular
and Extracellular Fluids.

Volume and Osmolality of Extracellular and Intracellular Fluids
in Abnormal States
ingestion of water
Dehydration
intravenous infusion of different types of solutions
loss of large amounts of fluid from the gastrointestinal tract, and
loss of abnormal amounts of fluid by sweating or through the
kidneys.

basic principles are kept in mind:
1. Water moves rapidly across cell membranes; therefore, the
osmolarities of intracellular and extracellular fluids remain
almost exactly equal to each other except for a few minutes
after a change in one of the compartments.
2. Cell membranes are almost completely impermeable to many
solutes; therefore, the number of osmoles in the extracellular or
intracellular fluid generally remains constant unless solutes are
added to or lost from the extracellular compartment.

Fluids used in clinical practice:
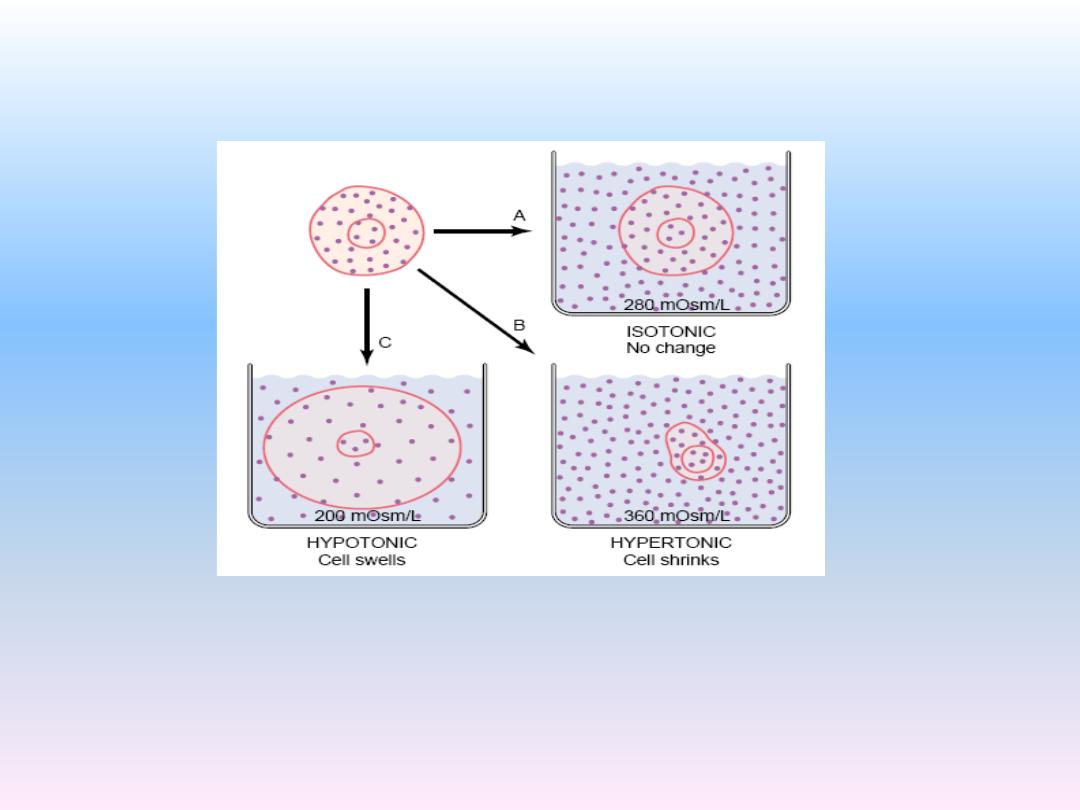
(1)Isotonic fluids:
If a cell is placed in a solution of impermeant solutes
having an osmolarity of 282 mOsm/L,. Such a solution
is said to be isotonic because it neither shrinks nor
swells the cells.
Examples of isotonic solutions include a 0.9 per cent
solution of sodium chloride or a 5 per cent glucose
solution. These solutions are important in clinical
medicine because they can be infused into the blood
without the danger of upsetting osmotic equilibrium
between the intracellular and extracellular fluids.

(2) Hypotonic fluid:
If a cell is placed into a hypotonic solution that has a
lower concentration of impermeant solutes (less than
282 mOsm/L), water will diffuse into the cell, causing
it to swell; water will continue to diffuse into the cell,
diluting the intracellular fluid while also concentrating
the extracellular fluid until both solutions have about
the same osmolarity. Solutions of sodium chloride with
a concentration of less than 0.9 per cent are hypotonic
and cause cells to swell.

(3)Hypertonic fluid:
If a cell is placed in a hypertonic solution having a
higher concentration of impermeant solutes, water
will flow out of the cell into the extracellular fluid,
concentrating the intracellular fluid and diluting the
extracellular fluid. In this case, the cell will shrink
until the two concentrations become equal. Sodium
chloride solutions of greater than 0.9 per cent are
hypertonic.

Effect of Adding Saline Solution to the Extracellular
Fluid
If an isotonic saline solution is added to the
extracellular fluid compartment, the osmolarity of the
extracellular fluid does not change; therefore, no
osmosis occurs through the cell membranes. The only
effect is an increase in extracellular fluid volume .The
sodium and chloride largely remain in the extracellular
fluid because the cell membrane behaves as though it
were virtually impermeable to the sodium chloride.

If a hypertonic solution is added to the extracellular
fluid:
the extracellular osmolarity increases and causes
osmosis of water out of the cells into the extracellular
compartment. Again, almost all the added sodium
chloride remains in the extracellular compartment, and
fluid diffuses from the cells into the extracellular space
to achieve osmotic equilibrium. The net effect is an
increase in extracellular volume (greater than the
volume of fluid added), a decrease in intracellular
volume, and a rise in osmolarity in both compartments

If a hypotonic solution is added to the extracellular
fluid:
the osmolarity of the extracellular fluid decreases
and some of the extracellular water diffuses into the
cells
until
the
intracellular
and
extracellular
compartments have the same osmolarity. Both the
intracellular and the extracellular volumes are increased
by the addition of hypotonic fluid, although the
intracellular volume increases to a greater extent.
Glucose and Other Solutions Administered for
Nutritive Purposes
