Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
1
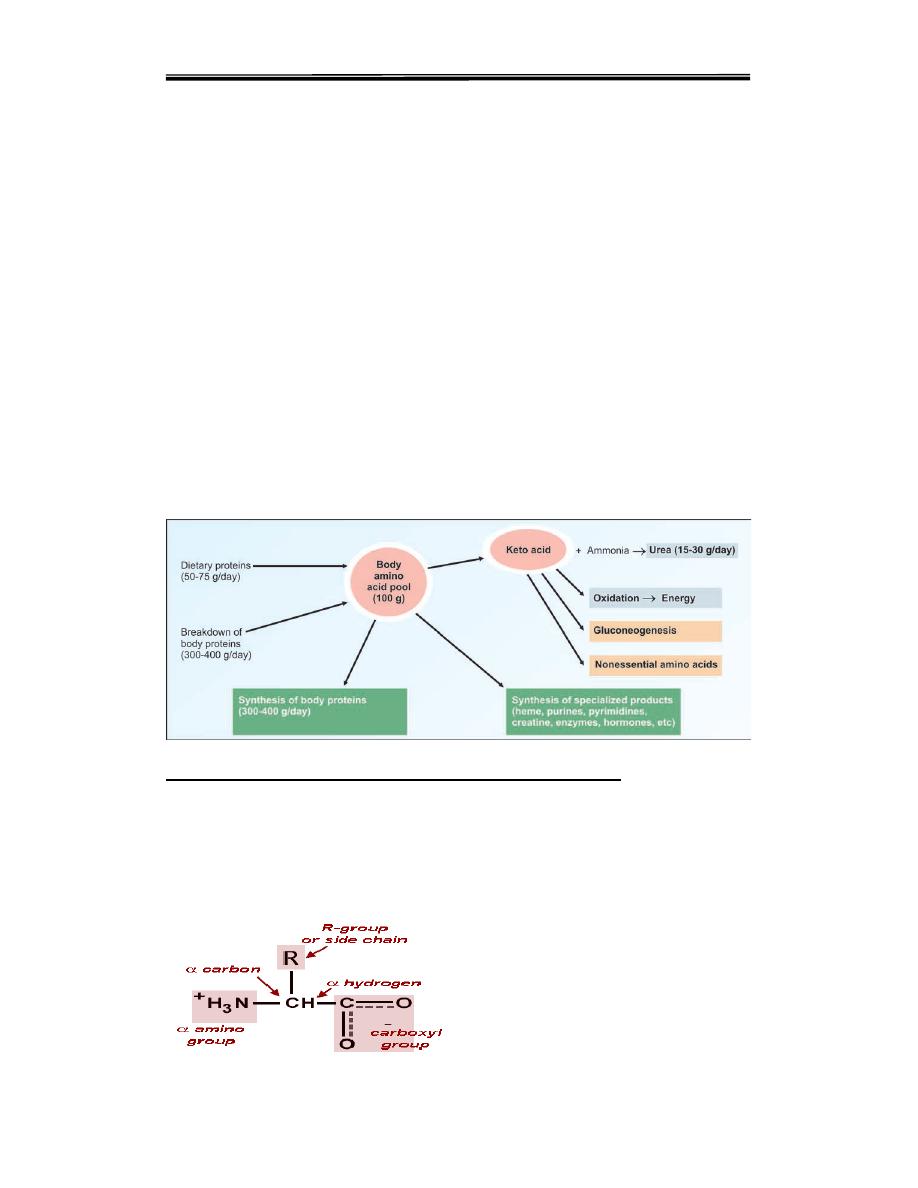
General Amino Acid Metabolism
The main role of amino acids is in the synthesis of structural and
functional proteins. Unlike carbohydrates and fats, there is no storage
form of proteins in the body.The body amino acid pool is always in a
dynamic steady state. In an adult, the rate of synthesis of proteins
balances the rate of degradation, so that nitrogen balance is
maintained .the main reaction of amino acid are
1. The anabolic reactions where proteins are synthesized.
2. Synthesis of specialized products such as heme,creatine, purines and
pyrimidines.
3. The catabolic reactions where dietary proteins and body proteins are
broken down to amino acids.
4. Transamination: amino group is removed to produce the carbon
skeleton (keto acid). The amino group liberated as ammonia is detoxified
and excreted as urea.
5. The carbon skeleton is used for synthesis of nonessential amino acids.
6. It is also used for gluconeogenesis
.
Figure (1)General Amino Acid Metabolism
DS
REMOVAL OF NITROGEN FROM AMINO ACI
The presence of the α-amino group keeps amino acids safely locked away
from oxidative breakdown. Removing the α-amino group is essential for
producing energy from any amino acid, and is an obligatory step in the
catabolism of all amino acids. Once removed, this nitrogen can be
incorporated into other compounds or excreted, with the carbon skeletons
being metabolized.
General structure of amino acid

Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
2
The first step in the catabolism of most amino acids is the transfer of their
α - amino group to α -ketoglutarate where the products are α - ketoacids
and glutamate. This transfer of amino groups from one carbon skeleton to
another is catalyzed by a family of transaminases which are also called
aminotransferases. Most of the amino acids undergo these reaction except
lysine and threonine
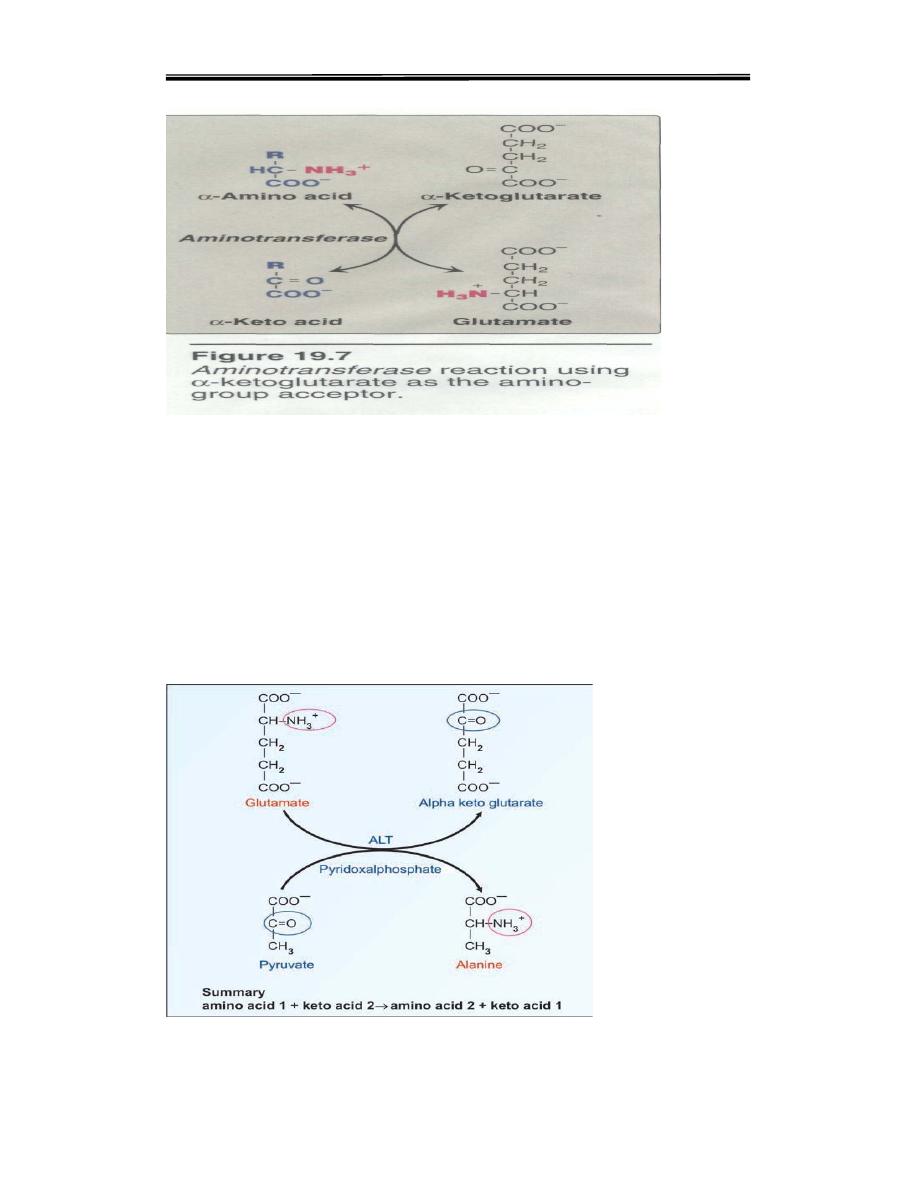
The main reaction of amino Acid :
A. Transamination: the tunneling of amino groups to glutamate
i. Transamination is the exchange of the alpha amino group between
one alphaamino acid and another alpha keto acid,forming a new alpha
amino acid.
amino acid 1 + keto acid 2 → amino acid 2 +keto acid 1
ii. As an example, amino group is interchanged between alanine and
glutamic acid (Fig. 14.8).In almost all cases, the amino group is accepted
by alpha ketoglutaric acid so that glutamic acid is formed.
The first step in the catabolism of most amino acids is the removal of
their α-amino group to α-ketoglutarate (Figure 19.7). The products are an
α-keto acid (derived from the original amino acid) and glutamate. a-
Ketoglutarate plays a unique role in amino acid metabolism by accepting
the amino groups from other amino acids, thus becoming glutamate.
Glutamate produced by transamination can be actively deaminated, or
used as an amino group donor in the synthesis of nonessential amino
acids.
The transfer of amino groups from one carbon skeleton to another is
catalyzed by a family of enzymes called aminotransferases (formerly
called transaminases). These enzymes are found in the cytosol of cells
throughout the -body—especially those of the liver, kidney, intestine,
and muscle. All amino acids, with the exception of lysine and threonine,
participate in transamination at some point in their catabolism. [Note:
These two amino acids lose their α-amino groups by deamination .
Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
3
Substrate specificity of aminotransferases:
Each aminotransferase is
specific for one or, at most, a few amino group donors.
Aminotransferases are named after the specific amino group donor,
because the acceptor of the amino group is almost always α-ketoglutarate.
The two most important aminotransferase reactions are catalyzed by
alanine aminotransferase
and aspartate aminotransferase
The enzymes catalysing the reaction as a group are known as amino
transferases.These enzymes have pyridoxal phosphate as prosthetic
group (Fig. 14.8). The reaction is readily reversible
Fig. 14.8. Transamination reaction. In this example,enzyme is Alanine
aminotransferase (ALT) andpyridoxal phosphate is the coenzyme. The reaction
is readily reversible

Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
4
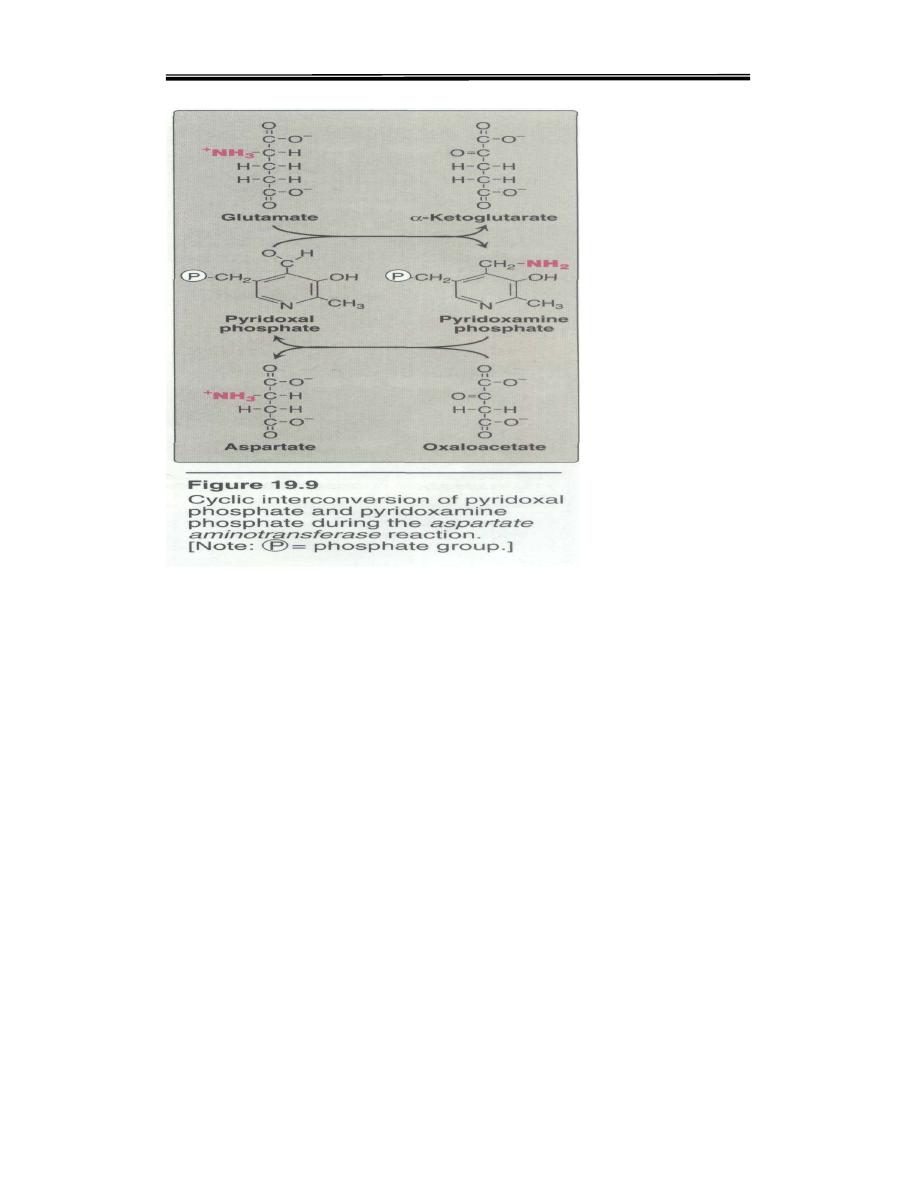
Mechanism of action of aminotransferases: All aminotransferases
require the coenzyme pyridoxal phosphate (a derivative) of vitamin B6,
which is covalently linked to the e-amino group of a specific lysine
residue at the active site of the enzyme. Aminotransferases act by
transferring the amino group of an amino acid to the pyridoxal part of the
coenzyme to generateate pyridoxamine phosphate. The pyridoxamine
form of coenzyme then reacts with an α-keto acid to form an amino acid
at the same time regenerating the original aldehyde form of the
coenzyme. Figure shows these two component the reaction catalyzed by
aspartate aminotransferase
Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
5
Transminase of Clinical Importance
Alanine transaminase (ALT) and Aspartate transaminase (AST) are the two
most important transaminases of clinical importance.
Function:
1- Degradation of a.as to form α- keto acids.
2- Synthesis of non essential a.as from CHO.
Diagnostic value:
Transaminases are normally intracellular enzymes. These enzymes are
abundant in heart and liver they are released as part of cell injury that occurs
in Myocardial infraction (MI),infections hepatitis and damage to either
organ They are elevated in the blood when damage to the cells producing
these enzymes occurs. Increase level of both ALT & AST
indicatespossible damage to the liver cells.
Increase level of AST alone suggest damage to heart muscle ,skeletal
muscle or kidney.
. Assays of these enzyme activities in blood serum can be used both in
diagnosis and monitoring the progress of a patient during treatment.

Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
6
B.Glutamate dehydrogenase ; Oxidative deamination of amino acid
incontrast to transamination reactions that transfer amino groups the
oxidative deamination by Glutamate dehydrogenase results in the
liberation of the amino group as free ammonia These reactions occur
primarily in the liver and kidney. They provide α-ketoacids that can enter
the central pathway of energy metabolism ,and ammonia, which is a
source of nitrogen in urea synthesis
.
Oxidative Deamination of Glutamate(
Glutamate dehydrogenase
)
Glutamate dehydrogenase: As described above, the amino groups of
most amino acids are ultimately funneled to glutamate by means of
transamination with α-ketoglutarate. Glutamate is unique in that it is the
only amino acid that undergoes rapid oxidative deamination reaction
catalyzed by glutamate dehydrogenase (Figure 19.10). Therefore, the
sequential action of transamination (resulting in the collection of amino
groups from other amino acids onto α-ketoglutarate to produce glutamate
and the subsequent oxidative deamination of that glutamate (regenerating
α-ketoglutarate) provide a pathway whereby the amino groups of most
amino acids can be released as ammonia.
Coenzymes for Glutamate dehydrogenase is unusual in can use either
NAD+ or NADP+ as a coenzyme. NAD+ is used primarily in oxidative
deamination (the simultaneous loss of ammonia coupled with the
oxidation of the carbon skeleton and NADPH is used in reductive
amination (the simultaneous gain of ammonia coupled with the reduction
of the carbon skeleton

Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
7
The direction of the reaction
Glutamate dehydrogenase
of
Regulation
depends on:
1- Availability of the substrates:
--Relative conc. Of (α-ketoglutarate &NH3) and (glutamate).
--Ratio of NADP : NADPH+H
2- Allosteric regulation:
--Activators : ADP or GDP.
-- Inhibitors : ATP ,GTP & NADH
Transport of ammonia to the liver
All tissues produce some ammonia from a variety of compounds. The level
of ammonia in blood must be kept very low, because even slightly elevated
concentrations (hyperammonemia) are toxic to the central nervous system
Two mechanisms are available in humans for the transport of ammonia
from the peripheral tissues to the liver for its ultimate conversion to urea.
The first, found in most tissues, uses glutamine synthetase to combine
ammonia with glutamate to form non toxic transport form of ammonia
(Figure 19.13). The glutamine is ported in the blood to the liver where is
cleaved by glutaminase to produce glutamate and free ammonia
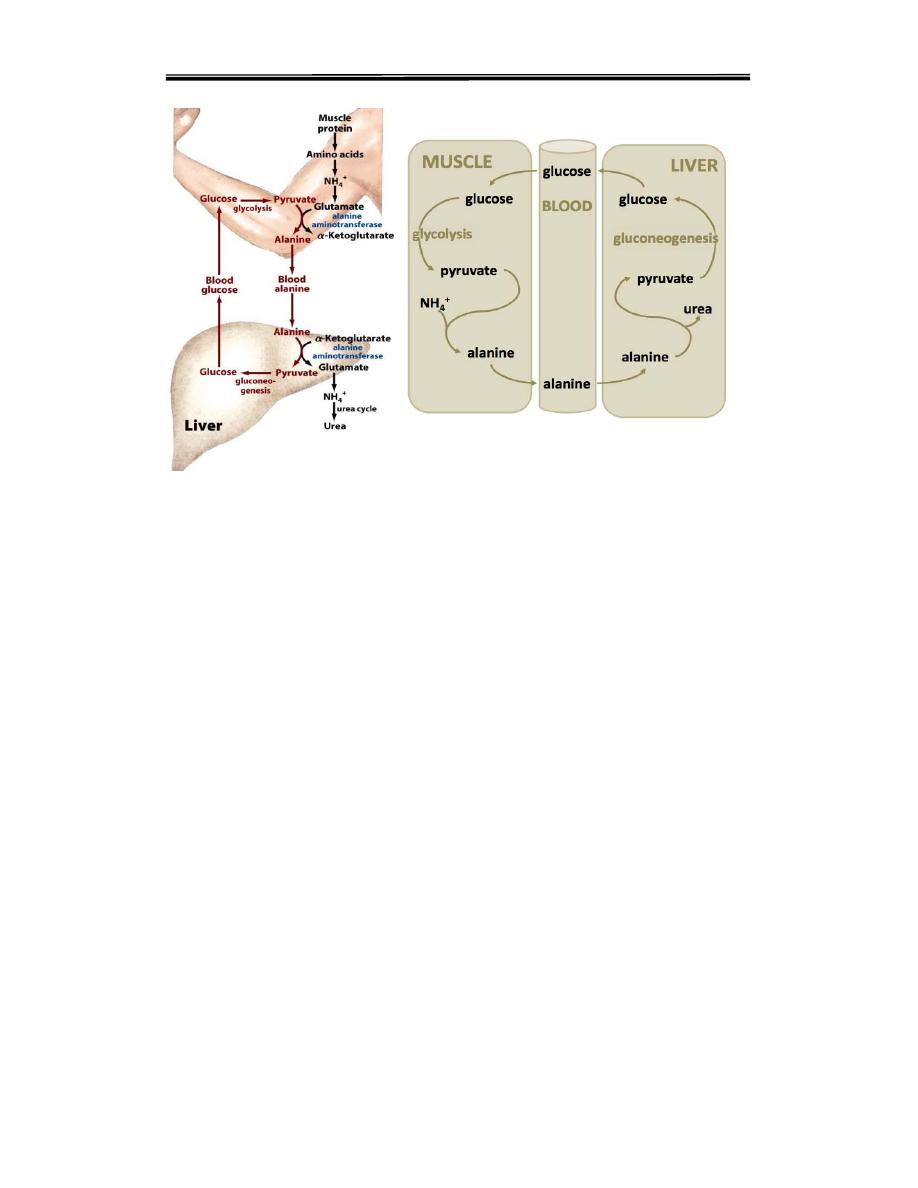
Second transport mechanism involves the glucose-alanine “cycle.”
Amino acids derived from skeletal muscle protein breakdown are
converted to Alanine, which is transported to liver where it is deaminated
to form pyruvate. Waste NH3 groups enter the urea cycle, while pyruvate
is used for gluconeogenesis( synthesize glucose) which can enter the
blood and be used by muscle a pathway called the glucose-alanine cycle.
Glucose-Alanine Cycle
i. Alanine is transported to liver, transaminated to
pyruvate and converted to glucose. This glucose may again enter
the glycolytic pathway to form pyruvate, which in turn,can be
transaminated to alanine.
ii. Glucose-alanine cycle is important in conditions of starvation (Fig.
9.30). Thus net transfer of amino acid (nitrogen) from muscle to liver and
corresponding transfer of glucose (energy) from liver to muscle is
effected.
Clinical biochemistry second stage lecture 2 Dr.Thana Alsewedy
8
In Fasting State
The muscle releases mainly alanine and glutamine of which alanine is
taken up by liver and glutamine by kidneys Liver removes the amino
group and converts it to urea and the carbonskeleton is used for
gluconeogenesis. The brain predominantly takes up branched chain
amino acids.
In the Fed State
Amino acids absorbed from the diet are taken up by different tissues.
Both muscle and brain take up branched chain amino acids, and release
glutamine and alanine. The glutamine is delivered to kidneys to aid in
regulation of acid–base balance while alanine is taken up by liver.
