1
Congenital heart diseases
Incidence:
Incidence of CHD is 8 in 1000 (1 in 100) in normal mother and father without family
history of CHD.
But if this family has one child with CHD the incidence in the second baby will
become 2-4 in 100, and third baby 8 in 100, and fourth baby 25 in 100.
Etiology:
Multifactorial
the causes could be genetic, teratogens, drugs, radiation, maternal
metabolic diseases, alcohol, and other causes.
Some are associated with chromosomal disorders, or single gene defects.
Teratogens & maternal drugs.
Maternal metabolic disease.
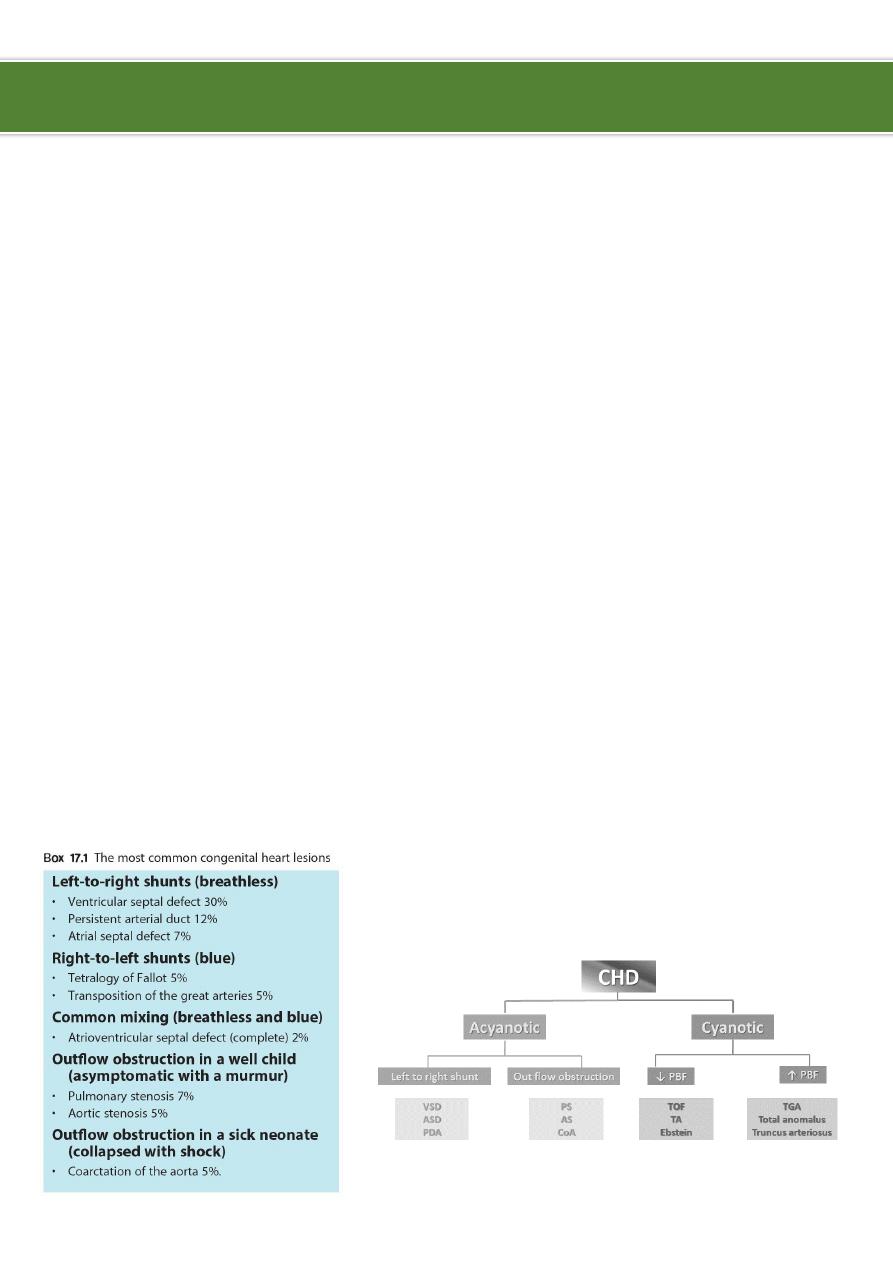
Classification of congenital heart diseases:
Group I Left to right shunts (acyanotic): ASD, VSD, PDA, AV Canal.
Group II Right to lefts shunts (cyanotic): TOF, TGA, TA, EA.
Group III Obstructive lesions: AS, PS, COA.
Ibnlatef
Notes
Pediatrics

2
Atrial Septal Defect (ASD):
ASD is an opening in the atrial septum permitting free
communication of blood between the atria.
Seen in 10% of all CHD.
There are 3 major types:
o
Secundum ASD at the Fossa ovalis, most common.
o
Primum ASD lower in position.
o
Sinus venosus ASD high in the atrial septum,
associated with anomalous venous return and the least common.
Most are asymptomatic but may have easy fatigability or mild growth failure.
Cyanosis does not occur unless pulmonary HTN is present.
Examination:
o
Hyperactive precordium.
o
RV heave.
o
Fixed widely split S2.
o
II-III/VI systolic ejection murmur at LSB.
o
Mid-diastolic murmur heard over LLSB indicates large defect.
Diagnosis:
o
Chest x-ray varying heart enlargement (right ventricular and right atrial),
increased pulmonary vessel markings, edema.
o
ECG right-axis deviation and RVH.
o
Echocardiogram definitive.
Treatment:
o
Surgical or catheterization laboratory closure is generally recommended for
secundum ASD with a Qp:Qs ratio >2:1.
o
Closure is performed electively between ages 2 & 5 years to avoid late
complications.
o
Surgical correction is done earlier in children with CHF or significant pulmonary
hypertension (HTN).
o
Once pulmonary HTN with shunt reversal occurs this is considered too late
(Eisnmenger syndrome).
o
Mortality is < 1%.
o
Infective Endocarditis is very rare in ASD.
Ventricular Septal Defect (VSD):
VSD is an abnormal opening in the ventricular septum,
which allows free communication between the Rt & Lt
ventricles.
Accounts for 25% of CHD

3
Types of VSD:
o
Membranous is below the aortic valve and is relatively small, it is the most
common of all VSDs.
o
Muscular may be single or multiple (Swiss cheese septum).
o
The inlet comprises endocardial cushion tissue.
o
Supra-cristal septum are less common, they are found just beneath the
pulmonary valve and may impinge on an aortic sinus and cause aortic
insufficiency.
Clinical Signs & Symptoms:
o
Small VSDs are often asymptomatic and the cardiac lesion is usually found
during routine physical examination. Characteristically, a loud, harsh, or blowing
holosystolic murmur is present and heard best over the lower left sternal border,
and it is frequently accompanied by a thrill.
o
Moderate to large VSDs result in pulmonary over circulation and heart failure,
presenting as fatigue, sweating with feedings difficulties, recurrent pulmonary
infections, and poor growth. Cyanosis is usually absent, but duskiness is
sometimes noted during infections or crying.
o
Symptoms develop between 1 - 6 months.
o
CHF, FTT, respiratory infections, exercise intolerance, hyperactive precordium.
o
Prominence of the left precordium is common, as are a palpable parasternal lift.
o
Laterally displaced apical impulse and a systolic thrill.
o
The holosystolic murmur of large VSD is generally less harsh than that of small
VSD.
Imaging studies:
o
ECG and CXR findings depend on the size of the VSD.
o
Small VSDs usually have normal studies.
o
Larger VSDs ECG findings of left atrial and ventricular enlargement and
hypertrophy.
o
CXR may reveal cardiomegaly, enlargement of the left ventricle, increase in the
pulmonary artery silhouette, and increased pulmonary blood flow.
o
Pulmonary hypertension due to either increased flow or increased pulmonary
vascular resistance may lead to right ventricular enlargement and hypertrophy.
o
Echocardiogram shows the position and size of the VSD.
Treatment:
o
Small VSD no surgical intervention, no physical restrictions, just reassurance
and periodic follow-up and endocarditis prophylaxis.
o
Symptomatic VSD Medical treatment initially with afterload reducers and
diuretics (± digoxin).
o
Prophylaxis against infective endocarditis (after dental or GU procedures).
Indications for surgical closure:
o
Large VSD with medically uncontrolled symptomatology & continued FTT.
4
o
Ages 6-12 months with large VSD & Pulmonary HTN.
o
Age > 24 months with Qp:Qs ratio > 2:1.
o
Supra-cristal VSD of any size.
Complications:
o
Large defects lead to heart failure, failure to thrive.
o
Endocarditis.
o
Pulmonary hypertension.
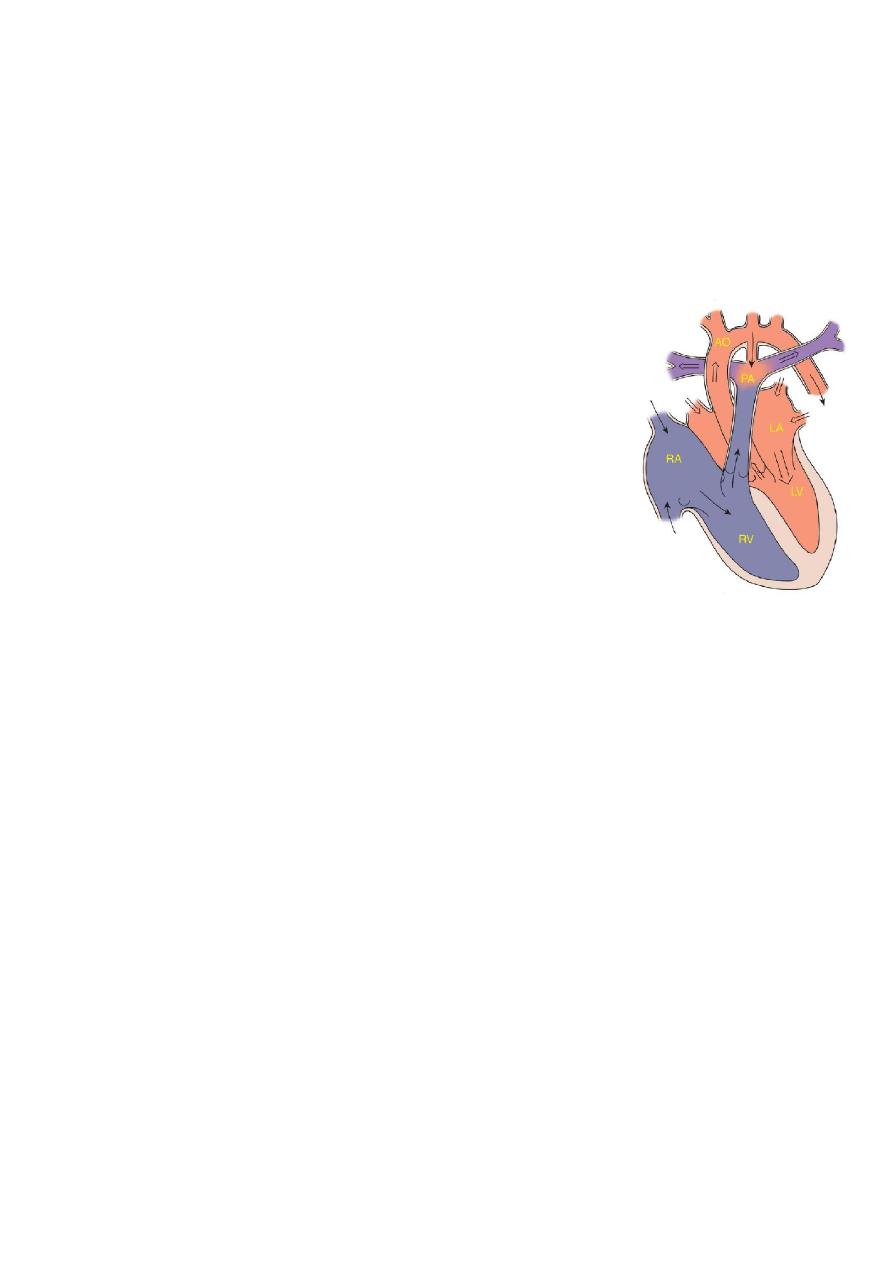
Patent Ductus Arteriosus (PDA):
Information:
o
During fetal life, most of the pulmonary arterial blood is
shunted right to-left through
the ductus arteriosus into
the aorta.
o
Functional closure of the ductus normally occurs soon
after birth.
o
If the ductus remains patent when pulmonary vascular
resistance falls, aortic blood then is shunted left-to-
right into the pulmonary artery.
o
So PDA: is persistence of the normal fetal vessel that joins the PA to the aorta.
o
Normally closes in the 1st week of life.
o
Accounts for 10% of all CHD.
o
Seen in 10% of other congenital heart lesions and can often play a critical role in
some lesions.
o
Female : Male ratio of 2:1
o
Often associated with coarctation & VSD.
o
Can be caused by congenital Rubella.
Clinical signs & symptoms:
o
Small PDA’s are usually asymptomatic.
o
Large PDA’s can result in symptoms of CHF, growth restriction, FTT.
o
Collapsing arterial pulses.
o
Widened pulse pressure.
o
Enlarged heart.
o
Prominent apical impulse.
o
Classic continuous machinary systolic murmur.
o
Mid-diastolic murmur at the apex.
Imaging studies:
o
ECG and chest x-ray findings are normal with small PDAs
o
Moderate to large shunts may result in a full pulmonary artery silhouette and
increased pulmonary vascularity.
5
o
ECG findings vary from normal to evidence of LVH, if pulmonary HTN is present,
there is also RVH.
Treatment:
o
Indomethacin inhibitor of prostaglandin synthesis can be used in premature
infants.
o
PDA requires surgical or catheter closure.
o
Closure is required for heart failure & to prevent pulmonary vascular disease.
o
Usually done by ligation & division or intra vascular coil.
o
Prophylaxis against infective endocarditis (after dental or GU procedures).
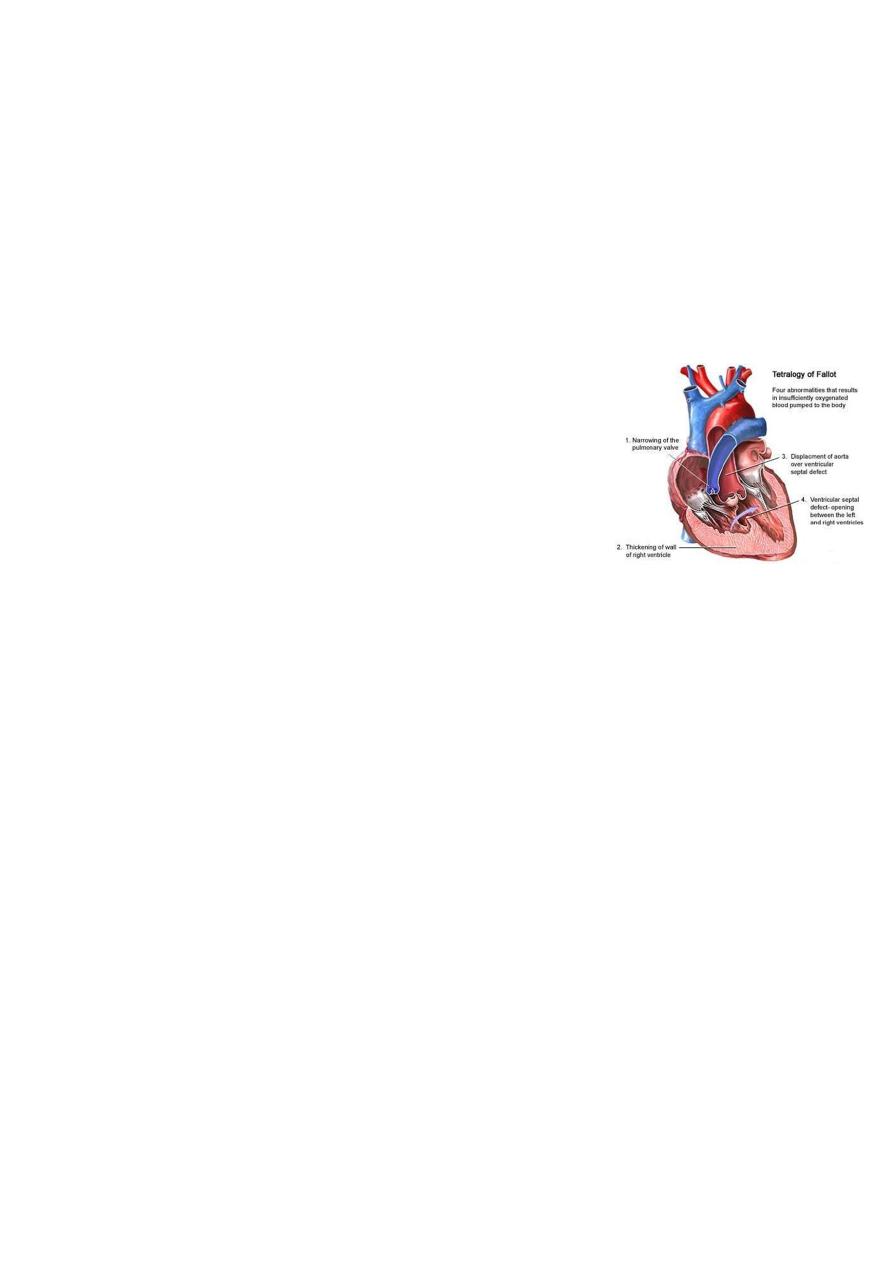
Tetralogy of Fallot (TOF):
It is the most common cyanotic congenital heart disease.
Components:
o
Pulmonary stenosis and infundibular stenosis
(obstruction to right ventricular outflow).
o
VSD.
o
Overriding aorta (overrides the VSD).
o
Right ventricular hypertrophy.
Hemodynamics:
o
Pulmonary stenosis plus hypertrophy of subpulmonic muscle (crista
supraventricularis).
o
Varying degrees of right ventricular outflow obstruction.
o
Blood shunted right-to-left across the VSD with varying degrees of arterial
desaturation and cyanosis.
Clinical picture:
o
Symptomatic any time after birth.
o
Hypoxic (Tet) spells:
Restlessness and agitation.
Inconsolable cry.
Squatting: increases the peripheral vascular resistance, which diminishes the
right-to-left shunt increases pulmonary blood flow.
Predominantly after waking up.
Dyspnea& cyanosis.
Loss of consciousness.
Convulsions.
Loss of the murmur.
Frequency varies from once a few days to many attack everyday.
Examination:
o
Varying degrees of cyanosis and a murmur.

6
o
Single S2 and right ventricular impulse at the left sternal border are typical
findings.
o
Clubbing of fingers and toes.
o
Cyanosis may not be apparent for the first few weeks of life until pulmonary
stenosis reach a critical level that cause reduction in pulmonary blood flow.
o
Therefore; the only finding in the first few days may be the murmur of PS.
Imaging studies:
o
ECG: RAD & RVH.
o
CXR: Boot-shaped heart.
Complications:
o
Each anoxic spell is potentially fatal.
o
Polycythemia may lead to cerebrovascular thrombosis (most often in patients
younger than 2 years).
o
Brain Abcess (usually in patients older than 2 years).
o
Anoxic infarction of CNS.
o
Infective endocarditis.
o
HF in some young infants with “pink” or acyanotic tetralogy of Fallot.
Treatment:
o
Management of anoxic spell:
Knee chest position.
Humified O2.
Be careful not to provoke the child.
Morphine 0.1 -0.2 mg/kg subcutaneously.
Correct acidosis sodium bicarb IV 1 mmol/kg slowly.
Propanolol start (0.1mg/kg/IV) slowly during spells followed by (0.5 to 1.0)
mg/kg/ 4-6hourly orally.
Vasopressors Methoxamine or Phenylephrine IM or IV drip.
GA is the last resort.
o
Surgery:
Palliative procedure (Blalock Taussig shunt) Subclavian artery-Pulmonary
artery anastomosis.
Definitive operation complete surgical repair with VSD closure and removal
or patching of the pulmonary stenosis can be performed in infancy.

7
Transposition of Great Arteries (TGA):
Information:
o
Aorta originating from the right ventricle, and pulmonary
artery originating from the left ventricle.
o
Accounts for 5-7% of all congenital heart disease.
o
Survival is dependent on the presence of mixing between
the pulmonary and systemic circulation.
o
Associated ASD, VSD, or PDA are essential for survival.
o
50% of patients have a VSD.
o
Usually presents in the first day of life with profound cyanosis.
o
More common in boys.
Examination:
o
A history of cyanosis is always present, although it depends on the amount of
mixing.
o
Tachypnea.
o
Single S2 are typically present, but may be split.
o
If the ventricular septum is intact, there may be no murmur.
o
Children with large VSD have improved intracardiac mixing and less cyanosis.
o
They may present with signs of heart failure.
o
The heart is hyperdynamic, with palpable left and right ventricular impulses.
o
A loud VSD murmur is heard.
Investigations:
o
CXR Egg on a string & narrow mediastinum.
o
Echo shows the TGA, the sites and amount of mixing, any associated lesions.
Acute management in newborn baby:
o
Initial medical management includes prostaglandin E1 to maintain ductal patency.
o
If significant hypoxia persists on prostaglandin therapy, a balloon atrial
septostomy improves mixing between the two circulations.
Surgical repair:
o
Aterial switch (old style).
o
Arterial switch (new).
Tricuspid atresia:
Information:
o
Tricuspid atresia accounts for approximately 2% of all CHD.
o
The absence of the tricuspid valve results in a hypoplastic right ventricle.
o
All systemic venous return must cross the atrial septum into the left atrium.
o
A PDA or VSD is necessary for pulmonary blood flow and survival.

8
Clinical manifestations:
o
Usually severely cyanosed.
o
Single S2.
o
If a VSD is present, there may be a murmur.
o
A diastolic murmur across the mitral valve may be audible.
o
Frequently there is no significant murmur
.
Investigation:
o
ECG: LVH & LAD.
o
CXR: normal or mildly enlarged cardiac silhouette, decreased pulmonary blood
flow.
o
Echo: shows the anatomy, associated lesions, and source of pulmonary blood
flow.
Treatment:
o
Medical PGE-1, minimal O2 to maintain ductal patency.
o
Palliative procedure Blalock-Taussig procedure.
o
Definitive bidirectional cavopulmonary shunt (bidirectional Glenn) and Fontan
procedure.
Bidirectional Glenn shunt showing the superior vena cava–right pulmonary
anastomosis.
Modified Fontan procedure (cavopulmonary isolation) involves
anastomosing of inferior vena cava to pulmonary artery.
Ebstein anomaly:
Information:
o
Downward displacement of abnormal tricuspid valve into right ventricle, the right
ventricle gets divided into two parts: an atrialized portion, which is thin-walled,
and smaller normal ventricular myocardium.
o
Right atrium is huge, tricuspid valve regurgitant.
o
Right ventricular output is decreased because:
Poorly functioning, small right ventricle.
Tricuspid regurgitation.
Variable right ventricular outflow obstruction: abnormal anterior tricuspid valve
leaflet, therefore, increased right atrial volume shunts blood through foramen
Ovale or ASD → cyanosis.
Clinical presentation:
o
Severity and presentation depend upon degree of displacement of valve and
degree of right ventricular outflow obstruction.
o
May not present until adolescence or adulthood.
o
If severe in newborn marked cyanosis, huge heart.
9
o
Pansystolic murmur of tricuspid insufficiency over most of anterior left chest
(most characteristic finding).
Investigations:
o
Chest x-ray heart size varies from normal to massive (increased right atrium), if
severe, decreased pulmonary blood flow.
o
ECG tall and broad P waves, RBBB, and a normal or prolonged PR interval.
o
Echo show the anatomy.
Treatment:
o
PGE1.
o
Systemic to pulmonary shunt.
o
Then staged surgery.
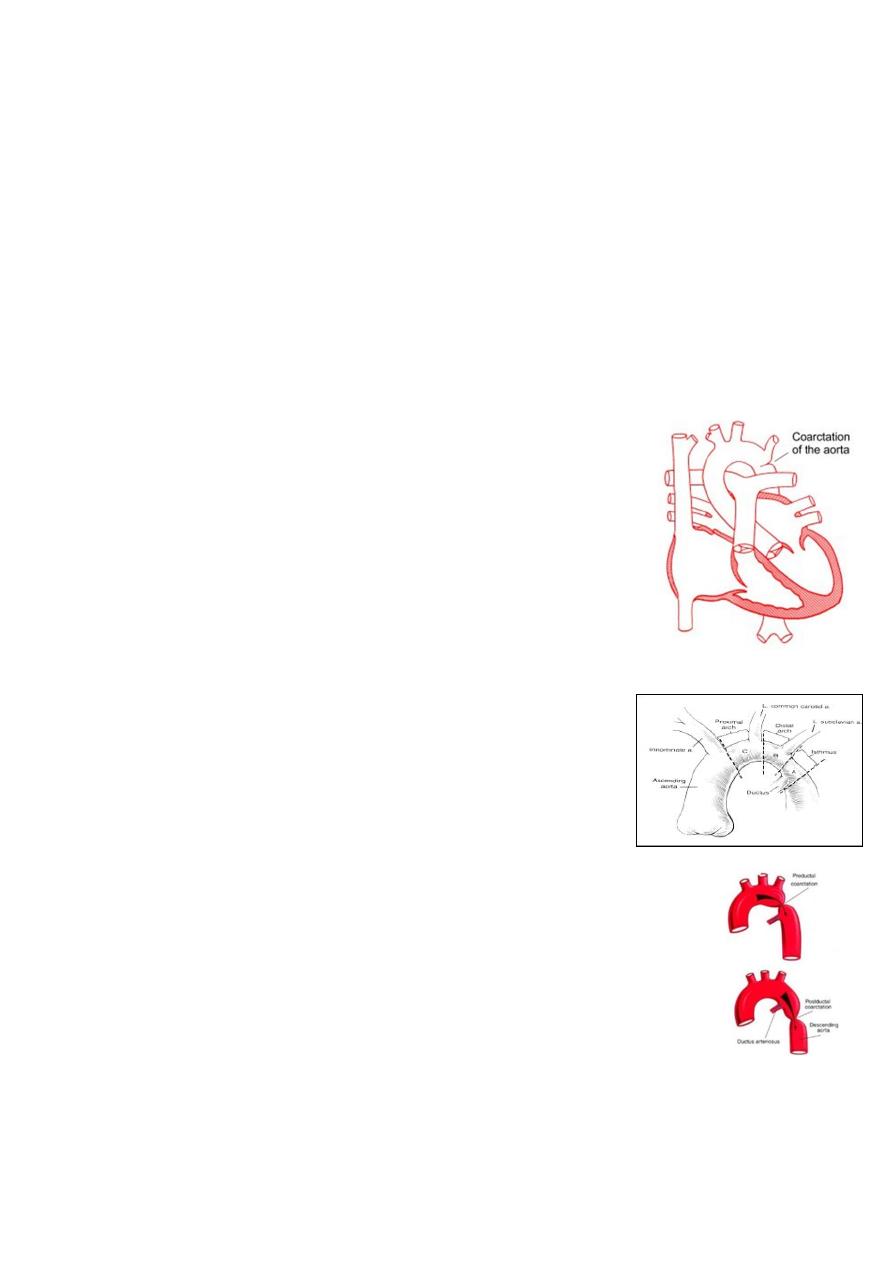
Coarctation of the Aorta (CoA):
Information:
o
It is narrowing of the aorta at varying points anywhere
from the transverse arch to the iliac bifurcation.
o
It is commonly associated with bicuspid valve.
o
More common in Turner’s syndrome.
o
98% of coarctations are juxtaductal.
o
Male:Female ratio 3:1.
o
Accounts for 7 % of all CHD.
o
The obstruction to blood flow will lead to LVH.
Pathophysiology:
o
Underdevelopment or hypoplasia of aortic arch or
isthmus.
Proximal arch.
Distal arch.
Isthmus.
o
Presence of ectopic ductal tissue in the aorta.
o
Hypoplasia of aortic arch & isthmus.
Types of coarctation:
o
Infantile type (preductal CoA).
o
Adult type (juxtaductal CoA) previously known as postductal type.
Preductal or infantile-type CoA:
o
CoA associated with aortic arch hypoplasia.
o
Right ventricular blood is ejected through the ductus to supply the descending
aorta.
o
Perfusion of the lower part of the body is then dependent on right ventricular
output.

10
o
In this situation, the femoral pulses are palpable, and differential blood pressures
may not be helpful in making the diagnosis.
o
The ductal right to-left shunting is manifested as differential cyanosis, with the
upper extremities being pink and the lower extremities blue.
o
Such infants may have severe pulmonary hypertension and high pulmonary
vascular resistance.
o
Signs of heart failure are prominent.
o
Coarctation associated with arch hypoplasia was once referred to as infantile type
because its severity usually led to recognition of the condition in early infancy.
Discrete juxtaductal or adult-type CoA:
o
Ascending aortic blood flows through the narrowed segment to reach the
descending aorta, although left ventricular hypertension and hypertrophy result.
o
In the 1st few days of life, the PDA may serve to widen the juxtaductal area of the
aorta and provide temporary relief from the obstruction.
o
Net left-to-right ductal shunting occurs in these acyanotic infants.
o
It is called adult type because it is was not usually recognized until later childhood.
o
Blood pressure is elevated in the vessels that arise proximal to the CoA, blood
pressure as well as pulse pressure is lower below the constriction.
Clinical signs & symptoms:
o
Clinical manifestation depend on:
Type of CoA.
Associated cardiac lesion as bicuspid aortic valve, subaortic stenosis, mitral
valve abnormalities, VSD.
Associated syndroms as turner.
Presence of collateral.
o
Infant:
Closure of ductus (7-10 days) produces severe HF, poor feeding, respiratory
distress, acidosis and shock.
Classically the femoral pulses are weaker and delayed compared with the right
radial pulse.
The blood pressure in the lower extremities is lower than that in the upper
extremities.
Ductus remains patent - differential cyanosis.
On examination, the heart is large, and a systolic murmur is heard along the
left sternal border.
o
Older children:
Asymptomatic.
Leg discomfort with exercise, headache, or epistaxis.
The classic sign of CoA is a disparity in pulsation and blood pressure in the arms
and legs.

11
The femoral, popliteal, posterior tibial, and dorsalis pedis pulses are weak (or
absent in up to 40% of patients), in contrast to the bounding pulses of the arms
and carotid vessels & hypertension in an upper extremity greater than the 95th
percentile for age.
If collateral present, there will be radial-femoral delay.
Systolic murmur is often heard along the left sternal border at the 3rd and 4th
intercostal spaces.
The murmur is well transmitted to the left infrascapular area and occasionally
to the neck.
If significant collaterals have developed, continuous murmurs may be heard
throughout the chest.
An abnormal aortic valve is present approximately 50% of the time, causing a
systolic ejection click and systolic ejection murmur of aortic stenosis.
Investigations:
o
Infant:
The ECG and chest x-ray show evidence of RVH with marked cardiomegaly and
pulmonary edema.
Echocardiography shows the site of coarctation and associated lesions.
o
In older children:
The ECG and chest x-ray usually show LVH and a mildly enlarged heart.
Rib notching may also be seen in older children (>8 years of age) with large
collaterals.
Echocardiography shows the site and degree of coarctation, presence of LVH,
and aortic valve morphology and function.
Treatment:
o
With severe coarctation maintaining the ductus with prostaglandin E is essential.
o
Surgical intervention, to prevent LV dysfunction.
o
Angioplasty is used by some centers.
o
Re-coarctation can occur, balloon angioplasty is the procedure of choice.
o
Prophylaxis against infective endocarditis (after dental or GU procedures).
Pulmonary stenosis:
PS accounts for approximately 10% of all congenital heart
disease and can be:
o
Valvular.
o
Subvalvular.
o
Supravalvular.
Clinical manifestations:
o
Symptoms depend on the degree of obstruction present:
Mild PS: right ventricle to pulmonary artery pressure gradient of ≤30 mm Hg.

12
Moderate PS: right ventricle to pulmonary pressure gradient 30-60 mm Hg.
Severe PS: right ventricle to pulmonary artery pressure gradient >60 mm Hg.
o
Mild PS: are asymptomatic .
o
Moderate to severe PS: results in exertional dyspnea and easy fatigability. If
hepatic enlargement and peripheral edema are present, they are an indication of
right ventricular failure .
o
Newborns with severe stenosis may be more symptomatic and even cyanotic
because of right-to-left shunting at the atrial level (patent foramen ovale), a
condition termed critical pulmonic stenosis.
o
PS causes a systolic ejection murmur at the second left intercostal space which
radiates to the back.
o
A thrill may be present.
o
S2 may be widely split.
o
With more severe pulmonary stenosis, an impulse at the lower left sternal border
results from RVH.
Investigations:
o
Mild PS: normal.
o
Moderate to severe PS: abnormal.
o
ECG: RAD & RVH.
o
CXR:
The heart size is usually normal (but may shows cardiac enlargement with
prominence of the right ventricle and right atrium).
The main PA segment may be prominent because of poststenotic dilation of the
main pulmonary artery.
o
Echo: show the anatomy & pressure gradient.
Treatment:
o
Mild PS: usually does not progress.
o
Moderate to severe PS: need the following.
o
Balloon valvuloplasty.
o
Surgical repair is required if balloon valvuloplasty is unsuccessful.
o
Valvar PS and balloon valvuloplasty
o
Inflation of the balloon catheter showing the indentation
(arrow) made on the balloon from the stenotic valve.
Aortic stenosis:
AS represents approximately 5% of all congenital heart
disease.
It is 3 types:
o
Valvular.
o
Subvalvular.
13
o
Supravalvular.
Clinical manifestations:
o
Symptoms depend on the degree of stenosis.
o
Mild to moderate AS: cause no symptoms.
o
Severe AS: results in easy fatigability, exertional chest pain, and syncope.
o
Sudden death if surgical relief delayed.
o
Infants with critical AS: may present with symptoms of LHF.
o
Systolic ejection murmur is heard at the right second intercostal space along the
sternum and radiating into the neck.
o
Thrill may be present at the right upper sternal border or in the suprasternal
notch.
Investigation:
o
Mild AS: normal.
o
Moderate to severe AS: abnormal.
o
ECG: LVH.
o
CXR: poststenotic dilation of the ascending aorta or aortic knob.
o
Echo: shows the anatomy & pressure gradient.
Treatment:
o
The degree of aortic stenosis frequently progresses with growth and age.
o
Balloon valvuloplasty is indicated for children with moderate to severe valvular AS
to prevent progressive left ventricular dysfunction & the risk of syncope and
sudden death.
o
Surgical management is necessary when balloon valvuloplasty is unsuccessful.
Regurgitant lesions:
Congenital Mitral Insufficiency.
Mitral Valve Prolapse.
Tricuspid Regurgitation
Notes:
If first baby has TOF the next baby could become with TOF or one of its component.
Important question: AV canal is the most common abnormality in baby with down
syndrome (40%)
AV canal = endocardial cushion defect = ostium primum ASD + High VSD + mitral
and/or tricuspid regurgitation.
Q: what is the case?
A: it is down syndrome.
Q: what do you want to examine?

14
A: cardiovascular system.
Q: what is the most common problem?
A: AV canal.
Eisenmenger syndrome L to R shunt become R to L shunt and the baby die, it is
not seen in baby less than 8 years of age.
Wide fixed S2 sound not seen in disease other than ostium secondium ASD.
Tricuspid valve diastolic murmur (flow murmur) indicate large valve defect.
Dominant ventricle in fetus is right ventricle physiological dominance of right
ventricle because aorta is connected to the placenta so the function of lest ventricle
is less and there is ductus arteriosus so right ventricle take 50% of function of left
ventricle and lung not function when baby is born the connection with placenta is
lost, and the lung is functioning, and the ductus arteriosus closed after few days
the physiological dominance of right ventricles become less and less.
RAD (right axis deviation) in newborn is normal but in adult is abnormal.
In newborn there is physiological dominance of right ventricle but in adult there is
right ventricular hyperplasia both have the same ECG changes.
In normal adult V1 lead (QRS complex directed downward) V6 lead (QRS complex
directed upward)
V1 with QRS complex directed upward in baby few months age is normal.
V1 with QRS complex directed upward in baby 5 years or 10 years or adult 50
years old is abnormal:
o
Right ventricular hypertrophy.
o
Pulmonary hypertension (cor pulmonale).
o
RBBB.
o
Pulmonary embolism.
o
Reciprocal changes of posterior MI.
LAD (left axis deviation) in baby is pathological with central cyanosis (tricuspid
atresia) without cyanosis (ostium premium ASD)
Ostium Secondum ASD narrow M shaped QRS in lead V1 (incomplete RBBB).
Most of ASD need surgical repair to close.
Most of VSD close by itself.
If systemic blood flow double the pulmonary blood flow indicator of closure of
defect.
If pulmonary blood flow double the systemic blood flow need surgery.
Infective endocarditis is very rare in ASD.
VSD is the most common CHD, it is 1/4 of all CHD.
Cheyne Stokes respiration normal in neonate especially in premature especially in
sleeping.
Peripheral cyanosis is normal in few days in neonate but central cyanosis is abnormal.
Hb level in neonate is 18-20 and in adult is 13-14 the baby become cyanosed in
cold weather or blood exchange.

15
Primum ASD lead to runs of arrhythmia, one component of AV canal, can lead to
LAD in children.
Pathological Q wave occur in MI and hypertrophic obstructive cardiomyopathy.
Cardiothoracic ratio (CT ratio) normally in adult is 50% and in infant is 60% because
adult can hold his breath during measuring the CT ration but infant cannot.
Don't diagnose baby as heart failure if there is no cardiomegaly in CXR.
VSA and PDA need prophylaxis of infective endocarditis.
In ASD there is murmur in pulmonary area because of overflow through the
pulmonary valve and it is flow murmur.
Premature baby has PO2 96% then sudden drop in PO2 and sweating during feed
it is heart failure due to PDA.
No machinery murmur in neonate:
o
Machinery murmur is systolic murmur that extend to diastole.
o
Pressure in aorta is higher than in pulmonary artery in systole and diastole so
there is machinery murmur in PDA.
o
No pressure gradient in neonate during diastole so there is only systolic murmur
(and no machinery murmur).
Indomethacin + O2 close ductus arteriosus.
Prostaglandin E1 + Not give O2 open ductus arteriosus.
Obstructive lesions in the right side (pulmonary atresia) in the left side (aortic
stenosis and coarctation of aorta)
Webbing of neck in female turner syndrome (come with coarctation of aorta and
aortic stenosis)
Coarctation of aorta is juxta ductal lesion, lead to radio-femoral delay, and the
femoral pulse is difficult to be felt.
TOF is the most common cyanotic CHD.
Important question: What are difference between cyanosis in TGA and TOF?
In TGA cyanosis at instant of birth.
In TOF cyanosis after few weeks.
The cyanosis increase when the stenosis of the infundibulum of aorta is increased.
In TOF the murmur is due to pulmonary stenosis and not due to VSD (rarely due to
VSD)
Most common complication of TOF is hypercyanotic spells.
Most serious complication of TOF is brain abscess and embolism.
TOF boot shaped heart.
Treatment of hypercyanotic spells Knee chest position + O2 + morphine (SC not
IV) + propranolol + sodium bicarbonate + phenylephrine.
Surgery of TOF palliative (bad prognosis) or corrective (good prognosis)
In TOF no HF, no orthopnea, no PND, no pulmonary edema because there is no
blood in the lung.
16
TGA is less common than TOF, but TGA also is common.
In TGA patient there is a defect like VSD, ASD, or PDA to survive.
Balloon septectomy used to destroy the atrial septum and mix blood between
right and left side of the heart in TGA patient.
In TGA there is cyanosis without dyspnea.
Tricuspid atresia small right ventricle with large left ventricle / single S2 (only
aortic) / need VSA or PDA / O2 will close the defect of VSD or PDA so not give to this
patient.
Blalock taussig shunt it is artificial ductus arteriosus, it is connection between
subclavian and pulmonary artery.
Ebstein anomaly called atrilization of right ventricle (lead to prominent P wave in
the ECG) the function and size of right ventricle will be less than normal.
Maternal infection early in pregnancy (possibly teratogenic) or later in pregnancy
(causing myocarditis or myocardial dysfunction in infants).
----------------------------------------------------------------------------------------------
www.facebook.com/ibnlatef
https://goo.gl/RpvNsl
