
Physiology
Lecture -1-
29/09/2015
Physiology of the body fluids

Physiology of the body fluids
Daily Intake of Water
Water is added to the body by two major sources: (1) it is ingested in the form of liquids or water in the
food, which together normally add about 2100 ml/day to the body fluids, and (2) it is synthesized in the
body as a result of oxidation of carbohydrates, adding about 200 ml/day. This provides a total water
intake of about 2300 ml/day. Intake of water, however, is highly variable among different people and
even within the same person on different days, depending on climate, habits, and level of physical
activity.
Daily Loss of Body Water
(1)Insensible Water Loss.
Some of the water losses cannot be precisely regulated. For example, there is
a continuous loss of water by evaporation from the respiratory tract and diffusion through the skin, which
together account for about 700 ml/day of water loss under normal conditions. This is termed insensible
water loss because we are not consciously aware of it, even though it occurs continually in all living
humans. The insensible water loss through the skin occurs independently of sweating and is present even
in people who are born without sweat glands; the average water loss by diffusion through the skin is
about 300 to 400 ml/day. This loss is minimized by the cholesterol-filled cornified layer of the skin,
which provides a barrier against excessive loss by diffusion. When the cornified layer becomes denuded,
as occurs with extensive burns, the rate of evaporation can increase as much as 10-fold, to 3 to 5 L/day.
For this reason, burn victims must be given large amounts of fluid, usually intravenously, to balance fluid
loss. Insensible water loss through the respiratory tract averages about 300 to 400 ml/day. As air
enters the respiratory tract, it becomes saturated with moisture, to a vapor pressure of about 47 mm Hg,
before it is expelled. Because the vapor pressure of the inspired air is usually less than 47 mm Hg, water
is continuously lost through the lungs with respiration. In cold weather, the atmospheric vapor pressure
decreases to nearly 0, causing an even greater loss of water from the lungs as the temperature decreases.
This explains the dry feeling in the respiratory passages in cold weather.
(2)Fluid Loss in Sweat. The amount of water lost by sweating is highly variable, depending on physical
activity and environmental temperature. The volume of sweat normally is about 100 ml/day, but in very
hot weather or during heavy exercise, water loss in sweat occasionally increases to 1 to 2 L/hour. This
would rapidly deplete the body fluids if intake were not also increased by activating the thirst mechanism.
(3)Water Loss in Feces. Only a small amount of water (100 ml/day) normally is lost in the feces. This
can increase to several liters a day in people with severe diarrhea.
(4)Water Loss by the Kidneys. The remaining water loss from the body occurs in the urine excreted by
the kidneys. For example, urine volume can be as low as 0.5 L/day in a dehydrated person or as high as
20 L/day in a person who has been drinking tremendous amounts of water.
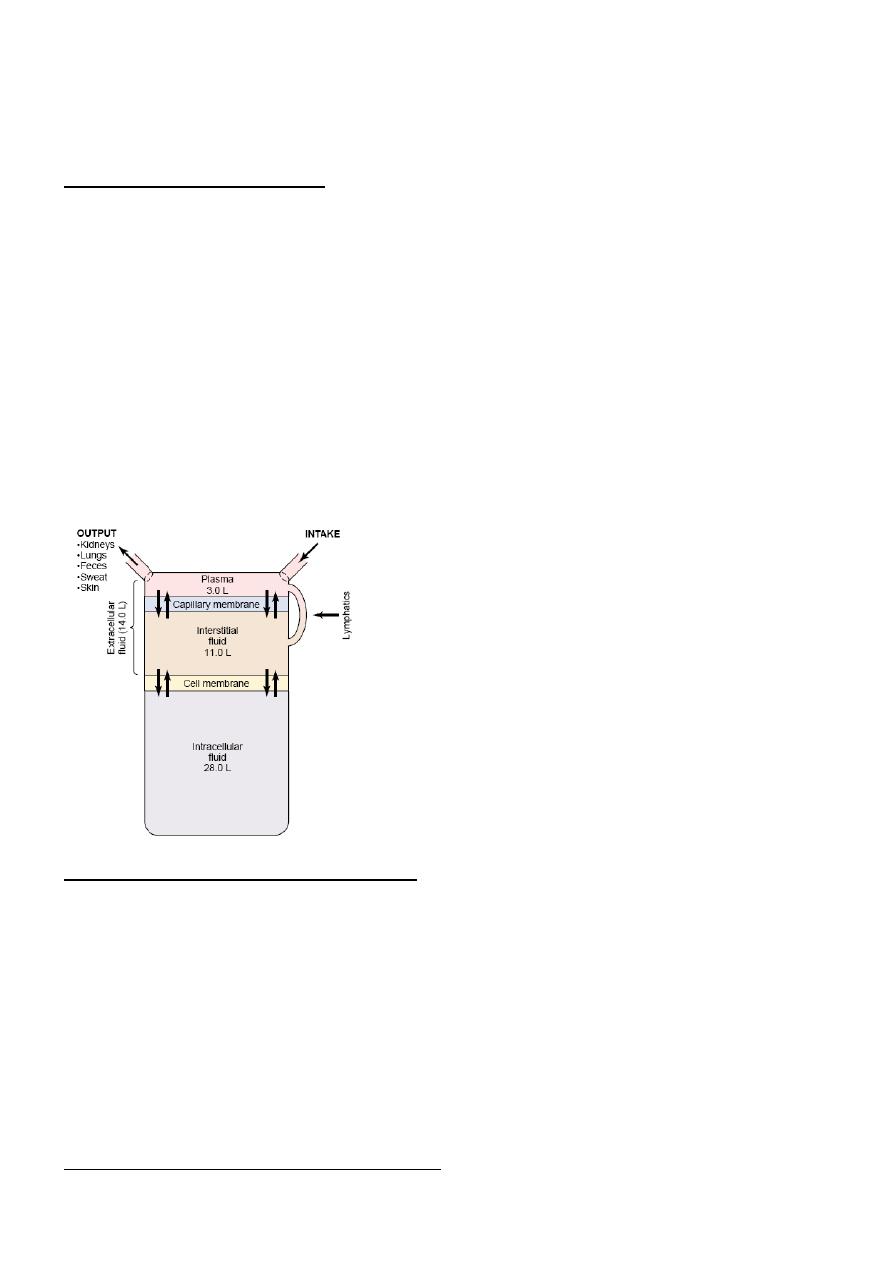
Body Fluid Compartments
The total body fluid is distributed mainly between two compartments: the extracellular fluid and the
intracellular fluid. The extracellular fluid is divided into the interstitial fluid and the blood plasma.
There is another small compartment of fluid that is referred to as transcellular fluid; this compartment
includes fluid in the synovial, peritoneal, pericardial, and intraocular spaces, as well as the cerebrospinal
fluid; it is usually considered to be a specialized type of extracellular fluid. All the transcellular fluids
together constitute about 1 to 2 liters.
In the average 70-kilogram adult human, the total body water is about 60 per cent of the body weight, or
about 42 liters. This percentage can change, depending on age, gender, and degree of obesity. As a person
grows older, the percentage of total body weight that is fluid gradually decreases. This is due in part to the
fact that aging is usually associated with an increased percentage of the body weight being fat, which
decreases the percentage of water in the body. Because women normally have more body fat than men,
they contain slightly less water than men in proportion to their body weight.
Intracellular Fluid Compartment
About 28 of the 42 liters of fluid in the body are inside the 75 trillion cells and are collectively called the
intracellular fluid. Thus, the intracellular fluid constitutes about 40 per cent of the total body weight in an
“average” person. The fluid of each cell contains its individual mixture of different constituents, but the
concentrations of these substances are similar from one cell to another.
Extracellular Fluid Compartment
All the fluids outside the cells are collectively called the extracellular fluid. Together these fluids account
for about 20 per cent of the body weight, or about 14 liters in a normal 70-kilogram adult. The two
largest compartments of the extracellular fluid are the interstitial fluid, which makes up more than three
fourths of the extracellular fluid, and the plasma, which makes up almost one fourth of the extracellular
fluid, or about 3 liters. The plasma is the noncellular part of the blood; it exchanges substances
continuously with the interstitial fluid through the pores of the capillary membranes. These pores are
highly permeable to almost all solutes in the extracellular fluid except the proteins. Therefore, the
extracellular fluids are constantly mixing, so that the plasma and interstitial fluids have about the same
composition except for proteins, which have a higher concentration in the plasma.
Blood Volume
Blood contains both extracellular fluid (the fluid in plasma) and intracellular fluid (the fluid in the red
blood cells). However, blood is considered to be a separate fluid compartment because it is contained in a
chamber of its own, the circulatory system. The blood volume is especially important in the control of
cardiovascular dynamics. The average blood volume of adults is about 7 per cent of body weight, or
about 5 liters. About 60 per cent of the blood is plasma and 40 per cent is red blood cells, but these
percentages can vary considerably in different people, depending on gender, weight, and other factors.
Important Constituents of Extracellular Fluid
Because the plasma and interstitial fluid are separated only by highly permeable capillary
membranes, their ionic composition is similar. The most important difference between these two
compartments is the higher concentration of protein in the plasma.
The extracellular fluid, including the plasma and the interstitial fluid, contains large amounts of sodium
and chloride ions, reasonably large amounts of bicarbonate ions, but only small quantities of
potassium, calcium, magnesium, phosphate, and organic acid ions. This allows the cells to remain
continually bathed in a fluid that contains the proper concentration of electrolytes and nutrients for
optimal cell function.
Important Constituents of the Intracellular Fluid
The intracellular fluid is separated from the extracellular fluid by a cell

membrane that is highly permeable to water but not to most of the electrolytes in the body. The
intracellular fluid contains large amounts of potassium and phosphate ions plus moderate quantities of
magnesium and sulfate ions, all of which have low concentrations in the extracellular fluid. Also, cells
contain large amounts of protein, almost four times as much as in the plasma. In contrast to the
extracellular fluid, it contains only small quantities of sodium and chloride ions and almost no calcium
ions.
Measurement of Fluid Volumes in the Different Body Fluid Compartments—The Indicator
Dilution Principle
The volume of a fluid compartment in the body can be measured by placing an indicator substance in the
compartment, allowing it to disperse evenly throughout the compartment’s fluid, and then analyzing the
extent to which the substance becomes diluted. “indicator-dilution” method of measuring the volume of
a fluid compartment, which is based on the principle of conservation of mass. This means that the total
mass of a substance after dispersion in the fluid compartment will be the same as the total mass injected
into the compartment. A small amount of dye or other substance contained in the syringe is injected into a
chamber, and the substance is allowed to disperse throughout the chamber until it becomes mixed in equal
concentrations in all areas. Then a sample of fluid containing the dispersed substance is removed and the
concentration is analyzed chemically, photoelectrically, or by other means. If none of the substance leaks
out of the compartment, the total mass of substance in the compartment (Volume B × Concentration B)
will equal the total mass of the substance injected (Volume A × Concentration A). By simple
rearrangement of the equation, we can calculate the unknown volume of chamber B as Note that all one
needs to know for this calculation is (1) the total amount of substance injected into the chamber and (2)
the concentration of the fluid in the chamber after the substance has been dispersed.
This method can be used to measure the volume of virtually any compartment in the body as long as:
(1) the indicator disperses evenly throughout the compartment.
(2) the indicator disperses only in the compartment that is being measured.
(3) the indicator is not metabolized or excreted.
Several substances can be used to measure the volume of each of the different body fluids.

Regulation of Fluid Exchange and Osmotic Equilibrium Between Intracellular and Extracellular
Fluid
The distribution of fluid between intracellular and extracellular compartments is determined
mainly by the osmotic effect of the smaller solutes— especially sodium, chloride, and other
electrolytes— acting across the cell membrane. The reason for this is that the cell membranes are highly
permeable to water but relatively impermeable to even small ions such as sodium and chloride. Therefore,
water moves across the cell membrane rapidly, so that the intracellular fluid remains isotonic with the
extracellular fluid.
Basic Principles of Osmosis and Osmotic Pressure
Osmosis is the net diffusion of water across a selectively permeable membrane from a region of high
water concentration to one that has a lower water concentration. When a solute is added to pure water,
this reduces the concentration of water in the mixture. Thus, the higher the solute concentration in a
solution, the lower the water concentration. Further, water diffuses from a region of low solute
concentration (high water concentration) to one with a high solute concentration (low water
concentration). Because cell membranes are relatively impermeable to most solutes but highly permeable
to water (i.e., selectively permeable), whenever there is a higher concentration of solute on one side of the
cell membrane, water diffuses across the membrane toward the region of higher solute concentration.
Thus, if a solute such as sodium chloride is added to the extracellular fluid, water rapidly diffuses from
the cells through the cell membranes into the extracellular fluid until the water concentration on both
sides of the membrane becomes equal. Conversely, if a solute such as sodium chloride is removed from
the extracellular fluid, water diffuses from the extracellular fluid through the cell membranes and into the
cells. The rate of diffusion of water is called the rate of osmosis.
Relation Between Moles and Osmoles. Because the water concentration of a solution depends on the
number of solute particles in the solution, a concentration term is needed to describe the total
concentration of solute particles, regardless of their exact composition. The total number of particles in a
solution is measured in osmoles. One osmole (osm) is equal to 1 mole (mol) (6.02 × 10
23
) of solute
particles. Therefore, a solution containing 1 mole of glucose in each liter has a concentration of 1 osm/L.
If a molecule dissociates into two ions (giving two particles), such as sodium chloride ionizing to give
chloride and sodium ions, then a solution containing 1 mol/L will have an osmolar concentration of
2osm/L. Likewise, a solution that contains 1 mole of a molecule that dissociates into three ions, such as
sodium sulfate (Na
2
SO
4
), will contain 3 osm/L. Thus, the term osmole refers to the number of osmotically
active particles in a solution rather than to the molar concentration. In general, the osmole is too large a
unit for expressing osmotic activity of solutes in the body fluids. The term milliosmole (mOsm), which
equals 1/1000 osmole, is commonly used.
Osmolality and Osmolarity. The osmolal concentration of a solution is called osmolality when the
concentration is expressed as osmoles per kilogram of water; it is called osmolarity when it is expressed

as osmoles per liter of solution. In dilute solutions such as the body fluids. In most cases, it is easier to
express body fluid quantities in liters of fluid rather than in kilograms of water.
Osmotic Pressure. Osmosis of water molecules across a selectively permeable membrane can be
opposed by applying a pressure in the direction opposite that of the osmosis. The precise amount of
pressure required to prevent the osmosis is called the osmotic pressure. Osmotic pressure, therefore, is an
indirect measurement of the water and solute concentrations of a solution. The higher the osmotic
pressure of a solution, the lower the water concentration and the higher the solute concentration of the
solution.
Relation Between Osmotic Pressure and Osmolarity. The osmotic pressure of a solution is directly
proportional to the concentration of osmotically active particles in that solution. This is true regardless of
whether the solute is a large molecule or a small molecule. For example, one molecule of albumin with a
molecular weight of 70,000 has the same osmotic effect as one molecule of glucose with a molecular
weight of 180. One molecule of sodium chloride, however, has two osmotically active particles,Na+ and
Cl–, and therefore has twice the osmotic effect of either an albumin molecule or a glucose molecule.
Thus, the osmotic pressure of a solution is proportional to its osmolarity, a measure of the concentration
of solute particles, for each milliosmole concentration gradient across the cell membrane, 19.3 mm Hg
osmotic pressure is exerted.
Osmolarity of the Body Fluids. about 80 per cent of the total osmolarity of the interstitial fluid and
plasma is due to sodium and chloride ions, whereas for intracellular fluid, almost half the osmolarity is
due to potassium ions, and the remainder is divided among many other intracellular substances. the total
osmolarity of each of the three compartments is about 300 mOsm/L, with the plasma being about 1
mOsm/L greater than that of the interstitial and intracellular fluids. The slight difference between plasma
and interstitial fluid is caused by the osmotic effects of the plasma proteins, which maintain about 20 mm
Hg greater pressure in the capillaries than in the surrounding interstitial spaces.
Osmotic Equilibrium Is Maintained Between Intracellular and Extracellular Fluids
Large osmotic pressures can develop across the cell membrane with relatively small changes in the
concentrations of solutes in the extracellular fluid. For each milliosmole concentration gradient of an
impermeant solute (one that will not permeate the cell membrane), about 19.3 mm Hg osmotic pressure is
exerted across the cell membrane. If the cell membrane is exposed to pure water and the osmolarity of
intracellular fluid is 282 mOsm/L, the potential osmotic pressure that can develop across the cell
membrane is more than 5400 mm Hg. This demonstrates the large force that can move water across the
cell membrane when the intracellular and extracellular fluids are not in osmotic equilibrium. As a result
of these forces, relatively small changes in the concentration of impermeant solutes in the extracellular
fluid can cause large changes in cell volume.
Volume and Osmolality of Extracellular and Intracellular Fluids in Abnormal States
Some of the different factors that can cause extracellular and intracellular volumes to change markedly
are ingestion of water, dehydration, intravenous infusion of different types of solutions, loss of large
amounts of fluid from the gastrointestinal tract, and loss of abnormal amounts of fluid by sweating or
through the kidneys. One can calculate both the changes in intracellular and extracellular fluid volumes
and the types of therapy that should be instituted if the following basic principles are kept in mind:
1. Water moves rapidly across cell membranes; therefore, the osmolarities of intracellular and
extracellular fluids remain almost exactly equal to each other except for a few minutes after a change in
one of the compartments.
2. Cell membranes are almost completely impermeable to many solutes; therefore, the number of osmoles
in the extracellular or intracellular fluid generally remains constant unless solutes are added to or lost
from the extracellular compartment. With these basic principles in mind, we can analyze the effects of
different abnormal fluid conditions on extracellular and intracellular fluid volumes and osmolarities.
Fluids used in clinical practice:
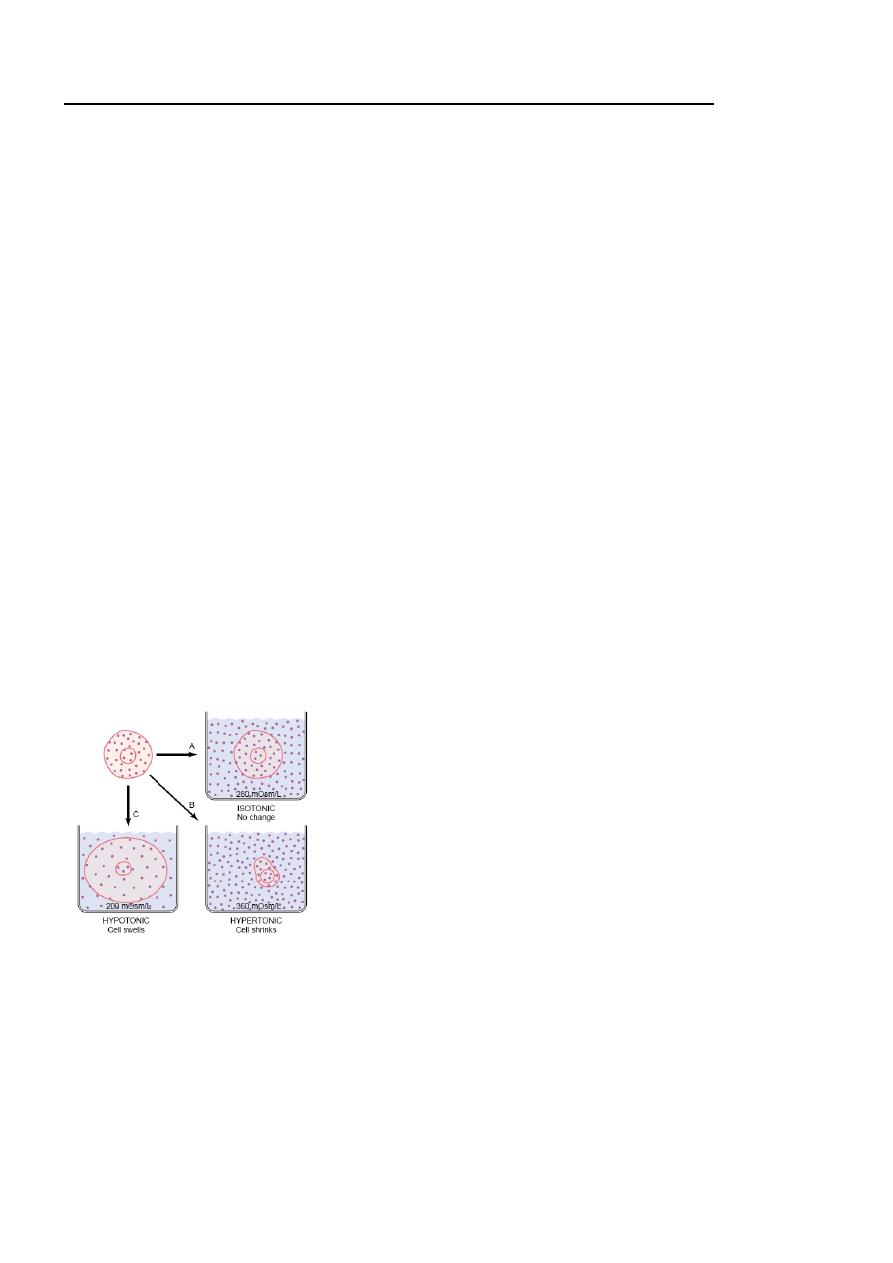
Isotonic, Hypotonic, and Hypertonic Fluids. If a cell is placed in a solution of impermeant solutes
having an osmolarity of 282 mOsm/L, the cells will not shrink or swell because the water concentration in
the intracellular and extracellular fluids is equal and the solutes cannot enter or leave the cell. Such a
solution is said to be isotonic because it neither shrinks nor swells the cells. Examples of isotonic
solutions include a 0.9 per cent solution of sodium chloride or a 5 per cent glucose solution. These
solutions are important in clinical medicine because they can be infused into the blood without the danger
of upsetting osmotic equilibrium between the intracellular and extracellular fluids. If a cell is placed into a
hypotonic solution that has a lower concentration of impermeant solutes (less than 282 mOsm/L), water
will diffuse into the cell, causing it to swell; water will continue to diffuse into the cell, diluting the
intracellular fluid while also concentrating the extracellular fluid until both solutions have about the same
osmolarity. Solutions of sodium chloride with a concentration of less than 0.9 per cent are hypotonic and
cause cells to swell. If a cell is placed in a hypertonic solution having a higher concentration of
impermeant solutes, water will flow out of the cell into the extracellular fluid, concentrating the
intracellular fluid and diluting the extracellular fluid. In this case, the cell will shrink until the two
concentrations become equal. Sodium chloride solutions of greater than 0.9 per cent are hypertonic.
Isosmotic, Hyperosmotic, and Hypo-osmotic Fluids. The terms isotonic, hypotonic, and hypertonic
refer to whether solutions will cause a change in cell volume. The tonicity of solutions depends on the
concentration of impermeant solutes. Some solutes, however, can permeate the cell membrane. Solutions
with an osmolarity the same as the cell are called isosmotic, regardless of whether the solute can
penetrate the cell membrane. The terms hyperosmotic and hypo-osmotic refer to solutions that have a
higher or lower osmolarity, respectively, compared with the normal extracellular fluid, without regard
for whether the solute permeates the cell membrane. Highly permeating substances, such as urea, can
cause transient shifts in fluid volume between the intracellular and extracellular fluids, but given enough
time, the concentrations of these substances eventually become equal in the two compartments and have
little effect on intracellular volume under steady-state conditions.

Effect of Adding Saline Solution to the Extracellular Fluid
If an isotonic saline solution is added to the extracellular fluid compartment, the osmolarity of the
extracellular fluid does not change; therefore, no osmosis occurs through the cell membranes. The only
effect is an increase in extracellular fluid volume .The sodium and chloride largely remain in the
extracellular fluid because the cell membrane behaves as though it were virtually impermeable to the
sodium chloride.
If a hypertonic solution is added to the extracellular fluid, the extracellular osmolarity increases and
causes osmosis of water out of the cells into the extracellular compartment. Again, almost all the added
sodium chloride remains in the extracellular compartment, and fluid diffuses from the cells into the
extracellular space to achieve osmotic equilibrium. The net effect is an increase in extracellular volume
(greater than the volume of fluid added), a decrease in intracellular volume, and a rise in osmolarity in
both compartments.
If a hypotonic solution is added to the extracellular fluid, the osmolarity of the extracellular fluid
decreases and some of the extracellular water diffuses into the cells until the intracellular and
extracellular compartments have the same osmolarity. Both the intracellular and the extracellular volumes
are increased by the addition of hypotonic fluid, although the intracellular volume increases to a greater
extent.
Glucose and Other Solutions Administered for Nutritive Purposes
Many types of solutions are administered intravenously to provide nutrition to people who cannot
otherwise take adequate amounts of nutrition. Glucose solutions are widely used, and amino acid and
homogenized fat solutions are used to a lesser extent. When these solutions are administered, their
concentrations of osmotically active substances are usually adjusted nearly to isotonicity, or they are
given slowly enough that they do not upset the osmotic equilibrium of the body fluids. After the glucose
or other nutrients are metabolized, an excess of water often remains, especially if additional fluid is
ingested. Ordinarily, the kidneys excrete this in the form of a very diluted urine. The net result, therefore,
is the addition of only nutrients to the body.
Fluid Filtration Across Capillaries
The capillary wall is a thin membrane made up of endothelial cells. Substances pass through the junctions
between endothelial cells and through fenestrations, when they are present. Some also pass through the
cells by vesicular transport or, in the case of lipid-soluble substances, through the cytoplasm. The factors
other than vesicular transport that are responsible for transport across the capillary wall are diffusion and
filtration. Diffusion is quantitatively much more important in terms of the exchange of nutrients and
waste materials between blood and tissue. O
2
and glucose are in higher concentration in the blood stream
than in the interstitial fluid and diffuse into the interstitial fluid, whereas CO
2
diffuses in the opposite
direction.
Fluid moves into the interstitial space at the arteriolar end of the capillary, where the filtration
pressure across its wall exceeds the oncotic pressure, and into the capillary at the venular end, where
the oncotic pressure exceeds the filtration pressure.
The hydrostatic pressure in the capillaries tends to force fluid and its dissolved substances through the
capillary pores into the interstitial spaces. Conversely, osmotic pressure caused by the plasma proteins
(called colloid osmotic pressure) tends to cause fluid movement by osmosis from the interstitial spaces
into the blood. This osmotic pressure exerted by the plasma proteins normally prevents significant loss of
fluid volume from the blood into the interstitial spaces. To distinguish this osmotic pressure from that
which occurs at the cell membrane, it is called either colloid osmotic pressure or oncotic pressure. The
term “colloid” osmotic pressure is derived from the fact that a protein solution resembles a colloidal
solution despite the fact that it is actually a true molecular solution.
Also important is the lymphatic system, which returns to the circulation the small amounts of excess
protein and fluid that leak from the blood into the interstitial spaces.

Normal Values for Plasma Colloid Osmotic Pressure.
The colloid osmotic pressure of normal human plasma averages about 28 mm Hg; 19 mm of this is
caused by molecular effects of the dissolved protein and 9 mm by the Donnan effect—that is, extra
osmotic pressure caused by sodium, potassium, and the other cations held in the plasma by the proteins
Interstitial Fluid Colloid Osmotic Pressure
Although the size of the usual capillary pore is smaller than the molecular sizes of the plasma proteins,
this is not true of all the pores. Therefore, small amounts of plasma proteins do leak through the pores
into the interstitial spaces. The total quantity of protein in the entire 12 liters of interstitial fluid of the
body is slightly greater than the total quantity of protein in the plasma itself, but because this volume is
four times the volume of plasma, the average protein concentration of the interstitial fluid is usually only
40 per cent of that in plasma, or about 3 g/dl. Quantitatively, one finds that the average interstitial fluid
colloid osmotic pressure for this concentration of proteins is about 8 mm Hg.
Exchange of Fluid Volume Through the Capillary Membrane
The average capillary pressure at the arterial ends of the capillaries is 15 to 25 mm Hg greater than at the
venous ends. Because of this difference, fluid “filters” out of the capillaries at their arterial ends, but at
their venous ends fluid is reabsorbed back into the capillaries. Thus, a small amount of fluid actually
“flows” through the tissues from the arterial ends of the capillaries to the venous ends. The dynamics of
this flow are as follows.
Analysis of the Forces Causing Filtration at the Arterial End of the Capillary.
The approximate average forces operative at the arterial end of the capillary that cause movement
through the capillary membrane are shown as follows:
Forces tending to move fluid outward:
Capillary pressure (arterial end of capillary) 30
Negative interstitial free fluid pressure 3
Interstitial fluid colloid osmotic pressure 8
total outward force 41
Forces tending to move fluid inward:
Plasma colloid osmotic pressure 28
total inward force 28
Summation of forces:
Outward 41
Inward 28
net outward force (at arterial end) 13
Thus, the summation of forces at the arterial end of the capillary shows a net filtration pressure of 13 mm
Hg, tending to move fluid outward through the capillary pores. This 13 mm Hg filtration pressure causes,
on the average, about 1/200 of the plasma in the flowing blood to filter out of the arterial ends of the
capillaries into the interstitial spaces each time the blood passes through the capillaries.
Analysis of Reabsorption at the Venous End of the Capillary.
The low blood pressure at the venous end of the capillary changes the balance of forces in favor of
absorption as follows:

Forces tending to move fluid inward:
Plasma colloid osmotic pressure 28
total inward force 28
Forces tending to move fluid outward:
Capillary pressure (venous end of capillary) 10
Negative interstitial free fluid pressure 3
Interstitial fluid colloid osmotic pressure 8
total outward force 21
Summation of forces:
Inward 28
Outward 21
net inward force 7
Thus, the force that causes fluid to move into the capillary, 28 mm Hg, is greater than that opposing
reabsorption, 21 mm Hg. The difference, 7 mm Hg, is the net reabsorption pressure at the venous ends of
the capillaries. This reabsorption pressure is considerably less than the filtration pressure at the capillary
arterial ends, but remember that the venous capillaries are more numerous and more permeable than the
arterial capillaries, so that less reabsorption pressure is required to cause inward movement of fluid. The
reabsorption pressure causes about nine tenths of the fluid that has filtered out of the arterial ends of the
capillaries to be reabsorbed at the venous ends. The remaining one tenth flows into the lymph vessels and
returns to the circulating blood.
Edema: Excess Fluid in the Tissues
Edema refers to the presence of excess fluid in the body tissues. In most instances, edema occurs mainly
in the extracellular fluid compartment, but it can involve intracellular fluid as well.
Intracellular Edema
Two conditions are especially prone to cause intracellular swelling: (1) depression of the metabolic
systems of the tissues, and (2) lack of adequate nutrition to the cells.
For example, when blood flow to a tissue is decreased, the delivery of oxygen and nutrients is reduced. If
the blood flow becomes too low to maintain normal tissue metabolism, the cell membrane ionic pumps
become depressed. When this occurs, sodium ions that normally leak into the interior of the cell can no
longer be pumped out of the cells, and the excess sodium ions inside the cells cause osmosis of water into
the cells.
Extracellular Edema
Extracellular fluid edema occurs when there is excess fluid accumulation in the extracellular spaces.

Factors That Affect the Net Rate of Diffusion
What is usually important is the net rate of diffusion of a substance in the desired direction. This net rate
is determined by several factors.
(1)Effect of Concentration Difference on Net Diffusion through a Membrane.
The rate at which the substance diffuses inward is proportional to the concentration of molecules on the
outside, because this concentration determines how many molecules strike the outside of the membrane
each second. Conversely, the rate at which molecules diffuse outward is proportional to their
concentration inside the membrane. Therefore, the rate of net diffusion into the cell is proportional to the
concentration on the outside minus the concentration on the inside, or: Net diffusion μ (Co - Ci)
in which Co is concentration outside and Ci is concentration inside.
(2)Effect of Membrane Electrical Potential on Diffusion of Ions—The “Nernst Potential.”
If an electrical potential is applied across the membrane, the electrical charges of the ions cause them to
move through the membrane even though no concentration difference exists to cause movement. Thus,
the concentration of negative ions is the same on both sides of the membrane, but a positive charge has
been applied to the right side of the membrane and a negative charge to the left, creating an electricrepels
them. Therefore, net diffusion occurs from left to right. After much time, large quantities of negative ions
have moved to the right, creating the condition in which a concentration difference of the ions has
developed in the direction opposite to the electrical potential difference. The concentration differeal
gradient across the membrane. The positive charge attracts the negative ions, whereas the negative charge
nce now tends to move the ions to the left, while the electrical difference tends to move them to the right.
When the concentration difference rises high enough, the two effects balance each other. At normal body
temperature (37°C), the electrical difference that will balance a given concentration difference of
univalent ions—such as sodium (Na+) ions—can be determined from the following formula, called the
Nernst equation:
which EMF is the electromotive force (voltage) between side 1 and side 2 of the membrane, C1 is in the
concentration on side 1, and C2 is the concentration on side 2. This equation is extremely important in
understanding the transmission of nerve impulses.
(3)Effect of a Pressure Difference across the Membrane.
Pressure actually means the sum of all the forces of the different molecules striking a unit surface area at
a given instant. Therefore, when the pressure is higher on one side of a membrane than on the other, this
means that the sum of all the forces of the molecules striking the channels on that side of the membrane is
greater than on the other side. The result is that increased amounts of energy are available to cause net
movement of molecules from the high-pressure side toward the low-pressure side.
At
times, considerable pressure difference develops between the two sides of a diffusible membrane. This
occurs, for instance, at the blood capillary membrane in all tissues of the body. The pressure is about 20
mm Hg greater inside the capillary than outside.

Osmosis Across Selectively Permeable Membranes— “Net Diffusion” of Water
By far the most abundant substance that diffuses through the cell membrane is water. Normally, the
amount that diffuses in the two directions is balanced so precisely that zero net movement of water
occurs. Therefore, the volume of the cell remains constant. However, under certain conditions, a
concentration difference for water can develop across a membrane, just as concentration differences for
other substances can occur. When this happens, net movement of water does occur across the cell
membrane, causing the cell either to swell or to shrink, depending on the direction of the water
movement. This process of net movement of water caused by a concentration difference of water is
called osmosis.
To give an example of osmosis, with pure water on one side of the cell membrane and a solution of
sodium chloride on the other side. Water molecules pass through the cell membrane with ease, whereas
sodium and chloride ions pass through only with difficulty. Therefore, sodium chloride solution is
actually a mixture of permeant water molecules and nonpermeant sodium and chloride ions, and the
membrane is said to be selectively permeable to water but much less so to sodium and chloride ions. Yet
the presence of the sodium and chloride has displaced some of the water molecules on the side of the
membrane where these ions are present and, therefore, has reduced the concentration of water molecules
to less than that of pure water. As a result more water molecules strike the channels on the left side, where
there is pure water, than on the right side, where the water concentration has been reduced. Thus, net
movement of water occurs from left to right—that is, osmosis occurs from the pure water into the sodium
chloride solution.
Osmotic Pressure
If pressure were applied to the sodium chloride solution, osmosis of water into this solution would be
slowed, stopped, or even reversed. The exact amount of pressure required to stop osmosis is called the
osmotic pressure of the sodium chloride solution.
a selectively permeable membrane separating two columns of fluid, one containing pure water and the
other containing a solution of water and any solute that will not penetrate the membrane. Osmosis of
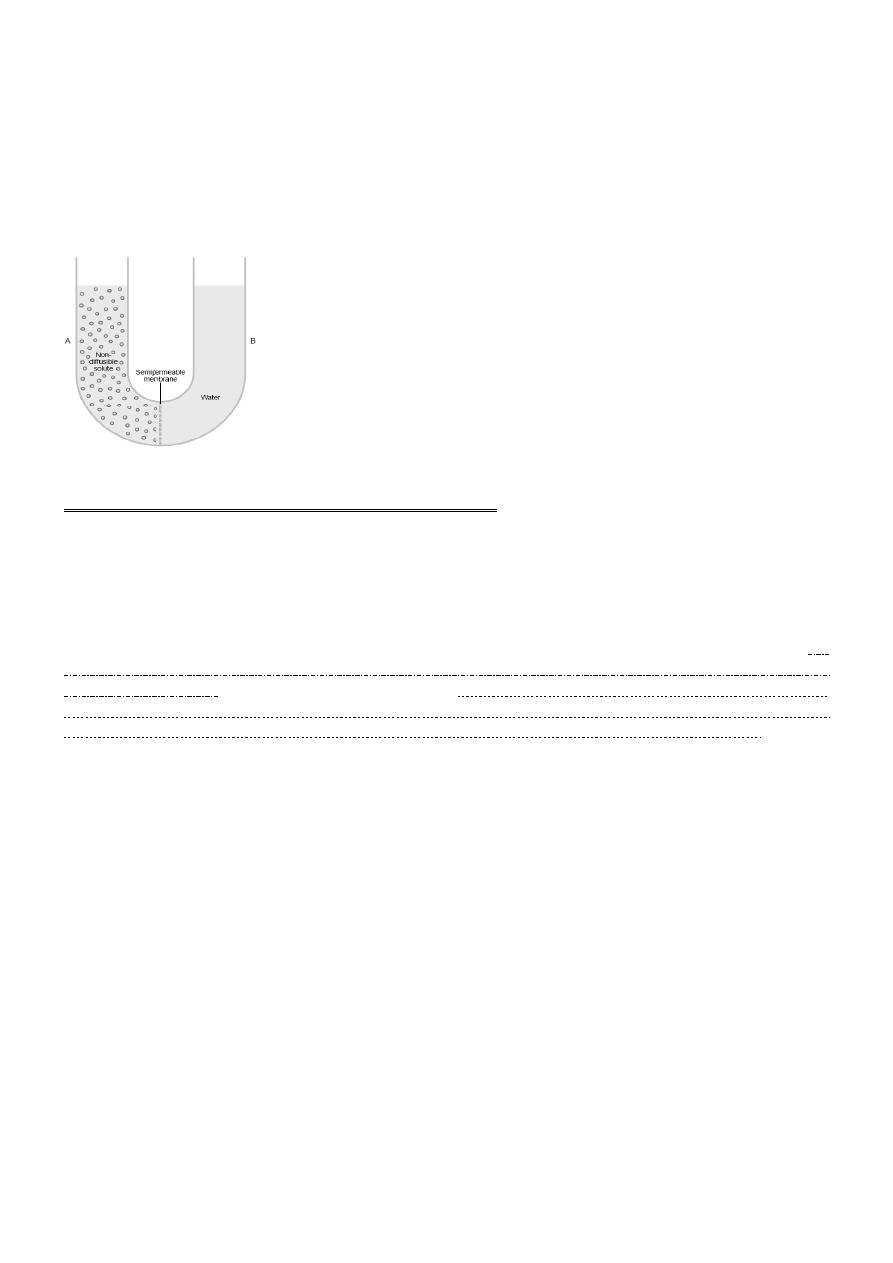
water from chamber B into chamber A causes the levels of the fluid columns to become farther and
farther apart, until eventually a pressure difference develops between the two sides of the membrane great
enough to oppose the osmotic effect. The pressure difference across the membrane at this point is equal to
the osmotic pressure of the solution that contains the nondiffusible solute.
The osmotic pressure exerted by particles in a solution, whether they are molecules or ions, is determined
by the number of particles per unit volume of fluid, not by the mass of the particles. The reason for this
is that each particle in a solution, regardless of its mass, exerts, on average, the same amount of pressure
against the membrane.
“Active Transport” of Substances Through Membranes
When a cell membrane moves molecules or ions “uphill” against a concentration gradient (or “uphill”
against an electrical or pressure gradient), the process is called active transport. Different substances that
are actively transported through at least some cell membranes include sodium ions, potassium ions,
calcium ions, iron ions, hydrogen ions, chloride ions, iodide ions, urate ions, several different sugars, and
most of the amino acids.
Active transport is divided into two types according to the source of the energy used to cause the
transport: primary active transport and secondary active transport. In primary active transport, the
energy is derived directly from breakdown of adenosine triphosphate (ATP) or of some other high-energy
phosphate compound. In secondary active transport, the energy is derived secondarily from energy that
has been stored in the form of ionic concentration differences of secondary molecular or ionic substances
between the two sides of a cell membrane, created originally by primary active transport. In both
instances, transport depends on carrier proteins that penetrate through the cell membrane, as is true for
facilitated diffusion. However, in active transport, the carrier protein functions differently from the
carrier in facilitated diffusion because it is capable of imparting energy to the transported substance to
move it against the electrochemical gradient.
Sodium-Potassium Pump as an example of Primary Active Transport:
The active transport mechanism that has been studied in greatest detail is the sodium-potassium (Na+-
K+) pump, a transport process that pumps sodium ions outward through the cell membrane of all cells
and at the same time pumps potassium ions from the outside to the inside. This pump is responsible for
maintaining the sodium and potassium concentration differences across the cell membrane, as well as for
establishing a negative electrical voltage inside the cells. This pump is also the basis of nerve function,
transmitting nerve signals throughout the nervous system. The carrier protein is a complex of two
separate globular proteins: a larger one called the a subunit, and a smaller one called the b subunit, the
larger protein has three specific features that are important for the functioning of the pump:
1. It has three receptor sites for binding sodium ions on the portion of the protein that protrudes to the
inside of the cell.
2. It has two receptor sites for potassium ions on the outside.
3. The inside portion of this protein near the sodium binding sites has ATPase activity.
When two potassium ions bind on the outside of the carrier protein and three sodium ions bind on the
inside, the ATPase function of the protein becomes activated. This then cleaves one molecule of ATP,
splitting it to adenosine diphosphate (ADP) and liberating a high-energy phosphate bond of energy. This
liberated energy is then believed to cause a chemical and conformational change in the protein carrier
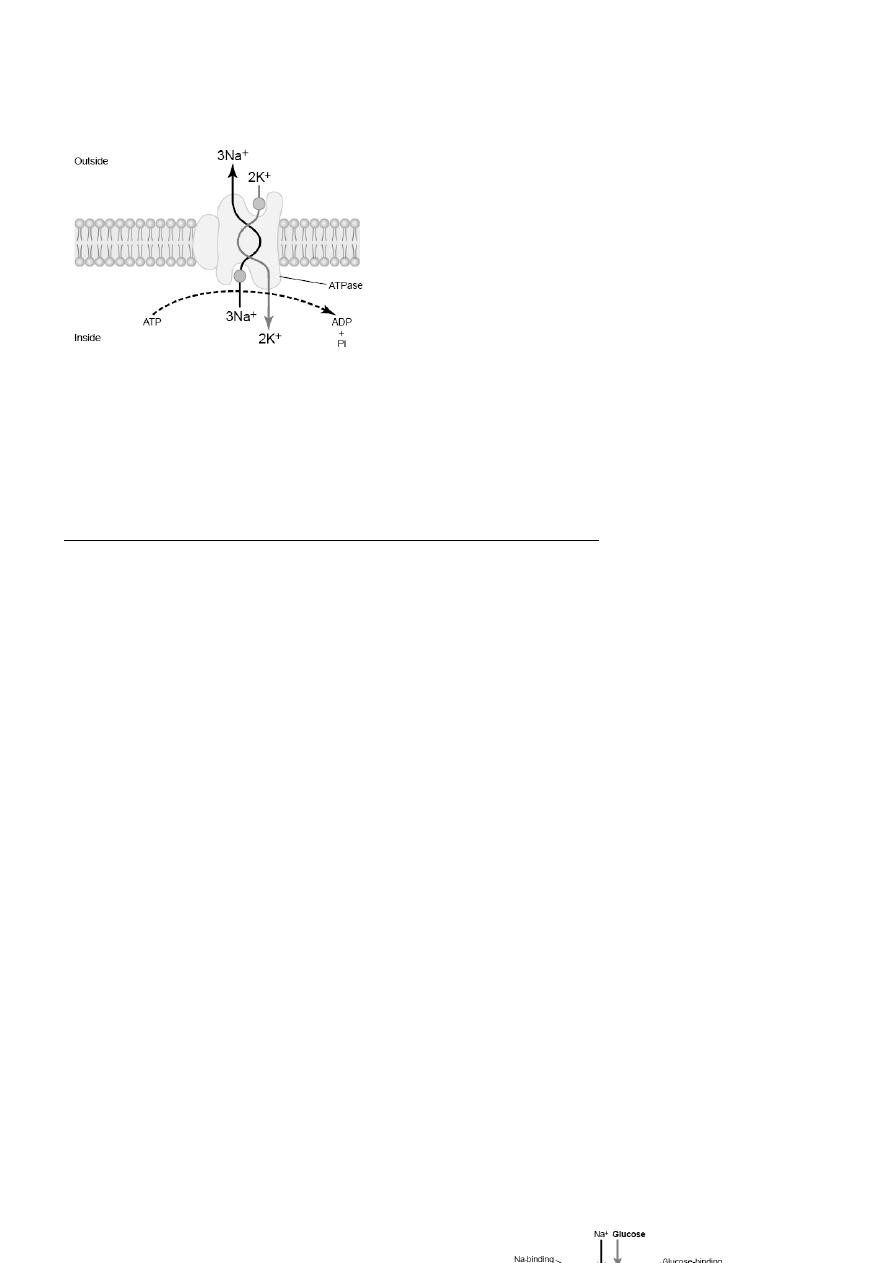
molecule, extruding the three sodium ions to the outside and the two potassium ions to the inside. For
some cells, such as electrically active nerve cells, 60 to 70 per cent of the cells’ energy requirement may
be devoted to pumping Na+ out of the cell and K+ into the cell.
Electrogenic Nature of the Na+-K+ Pump.
The fact that the Na+-K+ pump moves three Na+ ions to the exterior for every two K+ ions to the
interior means that a net of one positive charge is moved from the interior of the cell to the exterior for
each cycle of the pump. This creates positivity outside the cell but leaves a deficit of positive ions inside
the cell; that is, it causes negativity on the inside. Therefore, the Na+-K+ pump is said to be electrogenic
because it creates an electrical potential across the cell membrane. This electrical potential is a basic
requirement in nerve and muscle fibers for transmitting nerve and muscle signals.
Secondary Active Transport— Co-Transport and Counter-Transport
When sodium ions are transported out of cells by primary active transport, a large concentration gradient
of sodium ions across the cell membrane usually develops—high concentration outside the cell and very
low concentration inside. This gradient represents a storehouse of energy because the excess sodium
outside the cell membrane is always attempting to diffuse to the interior. Under appropriate conditions,
this diffusion energy of sodium can pull other substances along with the sodium through the cell
membrane. This phenomenon is called co-transport; it is one form of secondary active transport.
For sodium to pull another substance along with it, a coupling mechanism is required. This is achieved by
means of still another carrier protein in the cell membrane.
The carrier in this instance serves as an attachment point for both the sodium ion and the substance to be
co-transported. Once they both are attached, the energy gradient of the sodium ion causes both the sodium
ion and the other substance to be transported together to the interior of the cell. In counter-transport,
sodium ions again attempt to diffuse to the interior of the cell because of their large concentration
gradient. However, this time, the substance to be transported is on the inside of the cell and must be
transported to the outside. Therefore, the sodium ion binds to the carrier protein where it projects to the
exterior surface of the membrane, while the substance to be counter-transported binds to the interior
projection of the carrier protein. Once both have bound, a conformational change occurs, and energy
released by the sodium ion moving to the interior causes the other substance to move to the exterior.
Co-Transport of Glucose and Amino Acids Along with Sodium Ions
Glucose and many amino acids are transported into most cells against large concentration gradients; the
mechanism of this is entirely by co-transport. Note that the transport carrier protein has two binding sites
on its exterior side, one for sodium and one for glucose. Also, the concentration of sodium ions is very
high on the outside and very low inside, which provides energy for the transport. A special property of the
transport protein is that a conformational change to allow sodium movement to the interior will not occur
until a glucose molecule also attaches. When they both become attached, the conformational change takes
place automatically, and the sodium and glucose are transported to the inside of the cell at the same time.
Hence, this is a sodium-glucose co-transport mechanism. Sodium co-transport of the amino acids
occurs in the same manner as for glucose, except that it uses a different set of transport proteins. Five
amino acid transport proteins have been identified, each of which is responsible for transporting one
subset of amino acids with specific molecular characteristics. Sodium co-transport of glucose and amino
acids occurs especially through the epithelial cells of the intestinal tract and the renal tubules of the
kidneys to promote absorption of these substances into the blood. Other important co-transport
mechanisms in at least some cells include co-transport of chloride ions, iodine ions, iron ions, and urate
ions.
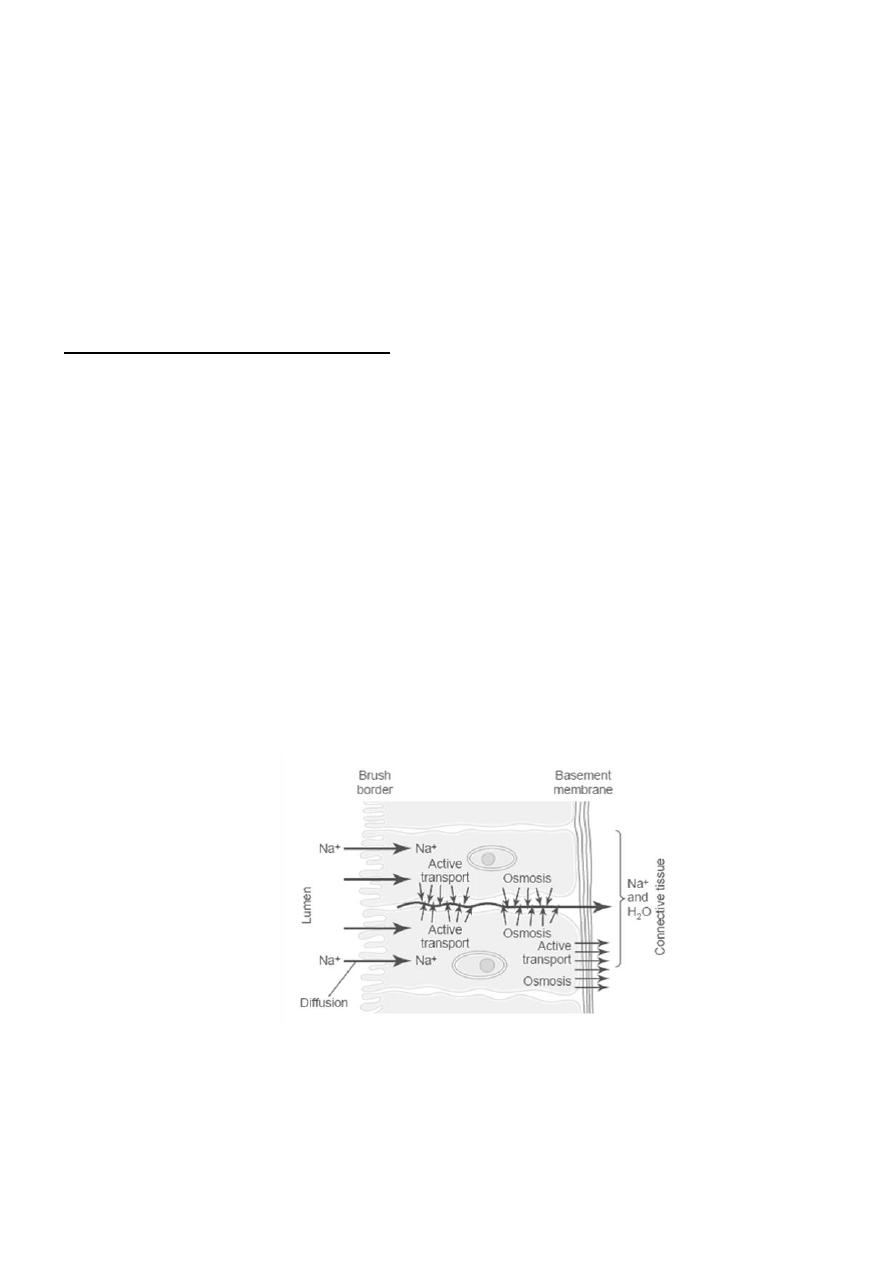
Active Transport Through Cellular Sheets
At many places in the body, substances must be transported all the way through a cellular sheet instead of
simply through the cell membrane. Transport of this type occurs through the (1) intestinal epithelium, (2)
epithelium of the renal tubules, (3) epithelium of all exocrine glands, (4) epithelium of the gallbladder,
and (5) membrane of the choroid plexus of the brain and other membranes.
The basic mechanism for transport of a substance through a cellular sheet is (1) active transport through
the cell membrane on one side of the transporting cells in the sheet, and then (2) either simple diffusion or
facilitated diffusion through the membrane on the opposite side of the cell. A mechanism for transport of
sodium ions through the epithelial sheet of the intestines, gallbladder, and renal tubules. This figure
shows that the epithelial cells are connected together tightly at the luminal pole by means of junctions
called“kisses.” The brush border on the luminal surfaces of the cells is permeable to both sodium ions and
water. Therefore, sodium and water diffuse readily from the lumen into the interior of the cell. Then, at
the basal and lateral membranes of the cells, sodium ions are actively transported into the extracellular
fluid of the surrounding connective tissue and blood vessels. This creates a high sodium ion concentration
gradient across these membranes, which in turn causes osmosis of water as well. Thus, active transport of
sodium ions at the basolateral sides of the epithelial cells results in transport not only of sodium ions but
also of water. These are the mechanisms by which almost all the nutrients, ions, and other substances are
absorbed into the blood from the intestine; they are also the way the same substances are reabsorbed from
the glomerular filtrate by the renal tubules.

