
Lecture 2
Atomic structure and interatomic bonding
1
Atomic structure
The mass and charge of Proton, Neutron, and Electron
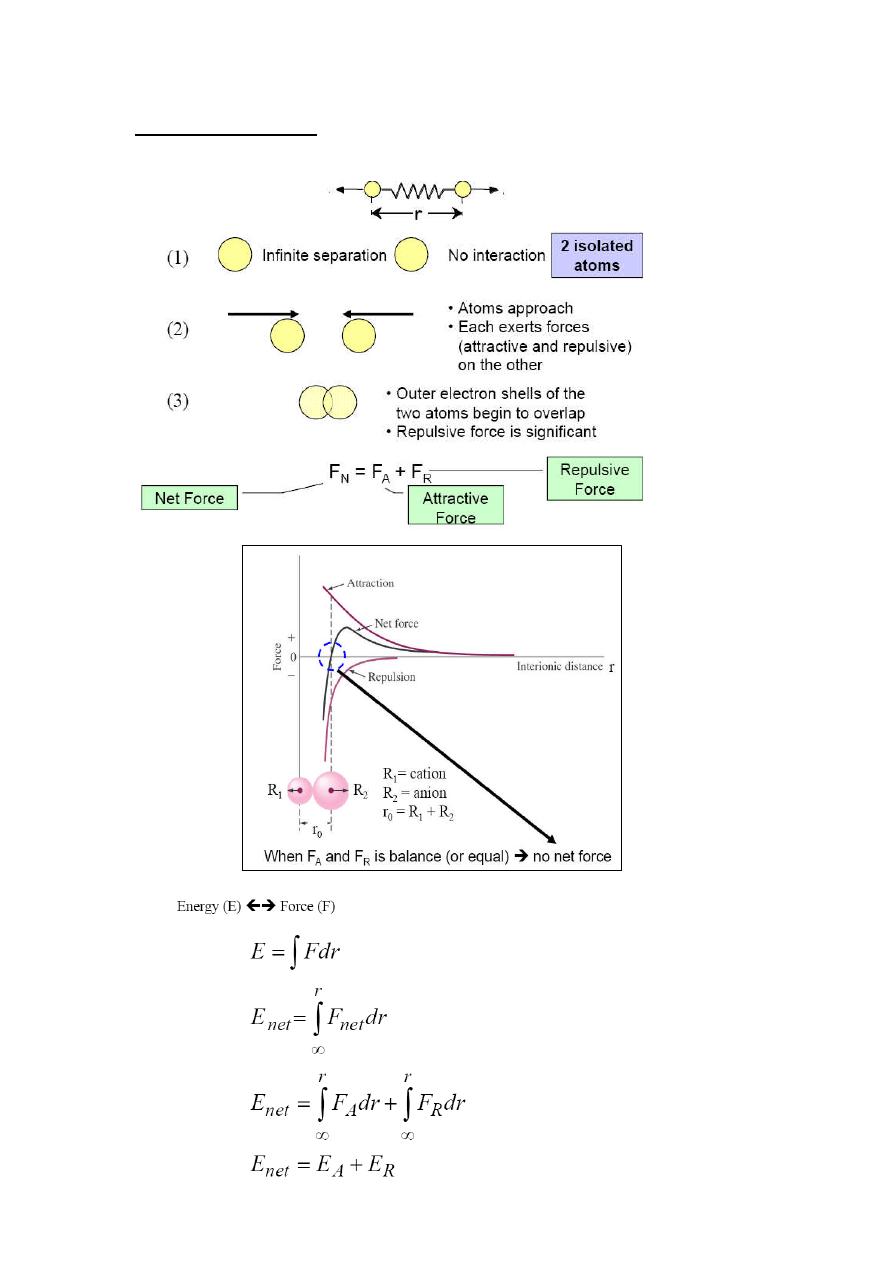
Bonding Forces & Energies
The nature of various states of matter (except plasma) can be explained by
using atomic forces (bonding forces) and potential energy of interatomic
distance.
There are 2 forces (attractive and repulsive) that act on a collection of atoms,
depending on the relative distances between various atoms.
Attractive forces acting on atoms
pull them together (would they collide?).
Repulsive forces (short range force) acting between nuclei and electrons of
individual atoms.
Nucleus (Proton + Neutron):
• Z (atomic number) = # protons
[1 for hydrogen to 94 for plutonium]
• N = # neutrons
Atomic mass (A) ≈
Z + N
Lecture 2
Atomic structure and interatomic bonding
2
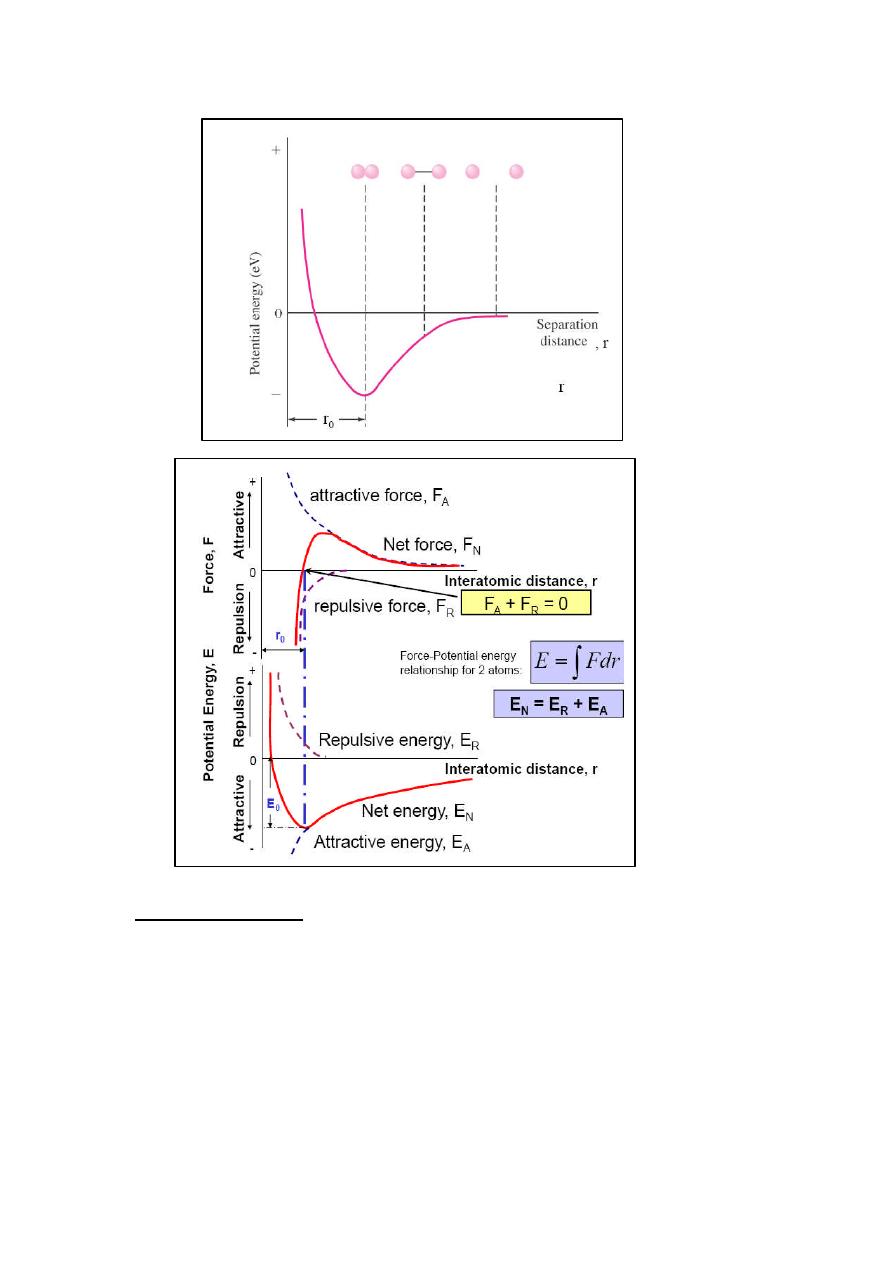
Forces between 2 atoms
Bond length
, r, = interatomic distance
Lecture 2
Atomic structure and interatomic bonding
3
Interatomic Bonds
Primary bonding
Ionic
Covalent
Metallic
Secondary Bonding
Van der Waals bonds
Lecture 2
Atomic structure and interatomic bonding
4
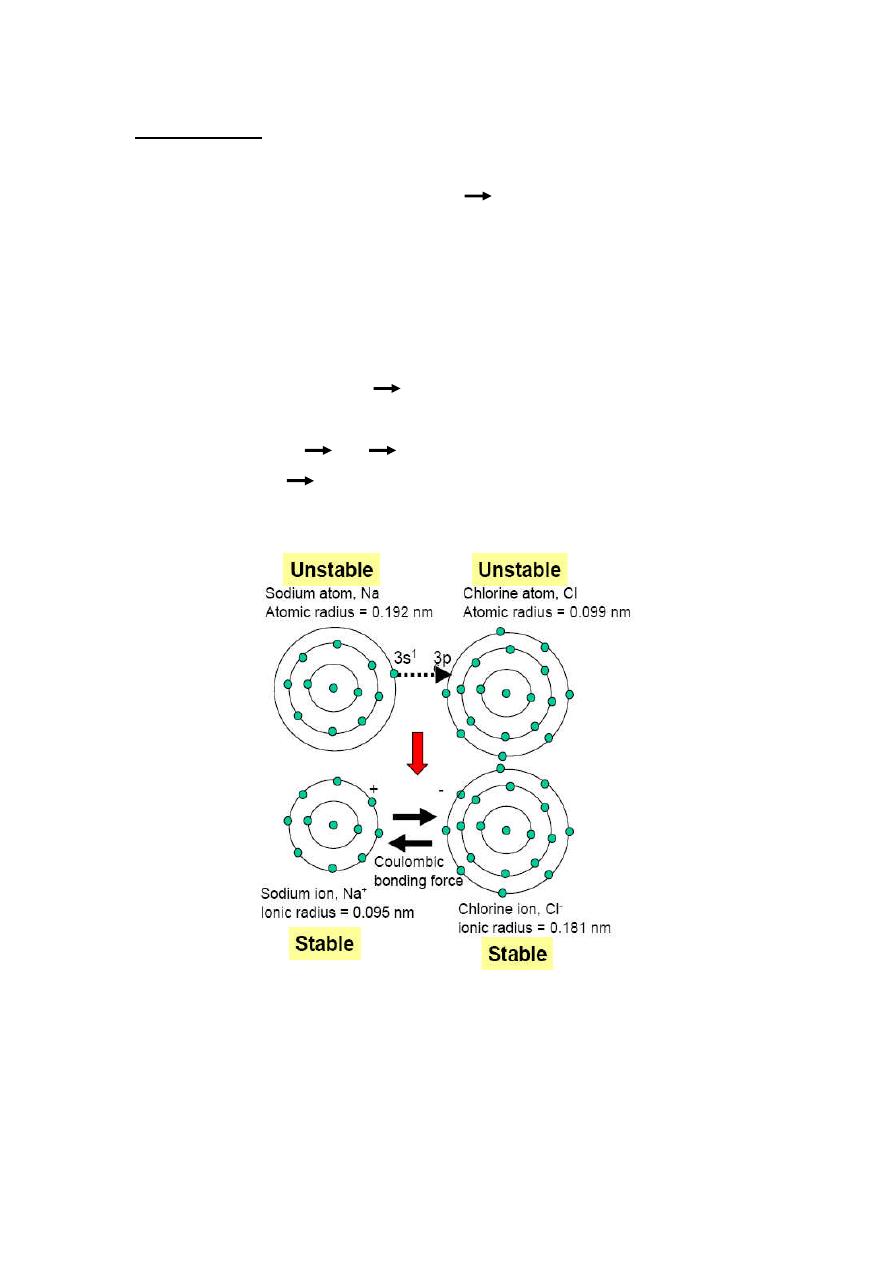
Ionic Bonding
Formed between highly electropositive (metallic) elements and highly
electronegative (nonmetallic) elements
large difference in electronegativity.
Ionization: electrons are transferred from atoms of electropositive elements to
atoms of electronegative elements, producing positively charged cations and
negatively charge anions.
Ionic bonding: due to electrostatic or Coulombic force attraction of
oppositely charged ions.
Nondirectional bonding
magnitude of the bond is equal in all directions
around an ion.
Binding energy
large
high melting temp.
Ionic material
hard, brittle, electrically and thermally insulative
Lecture 2
Atomic structure and interatomic bonding
5
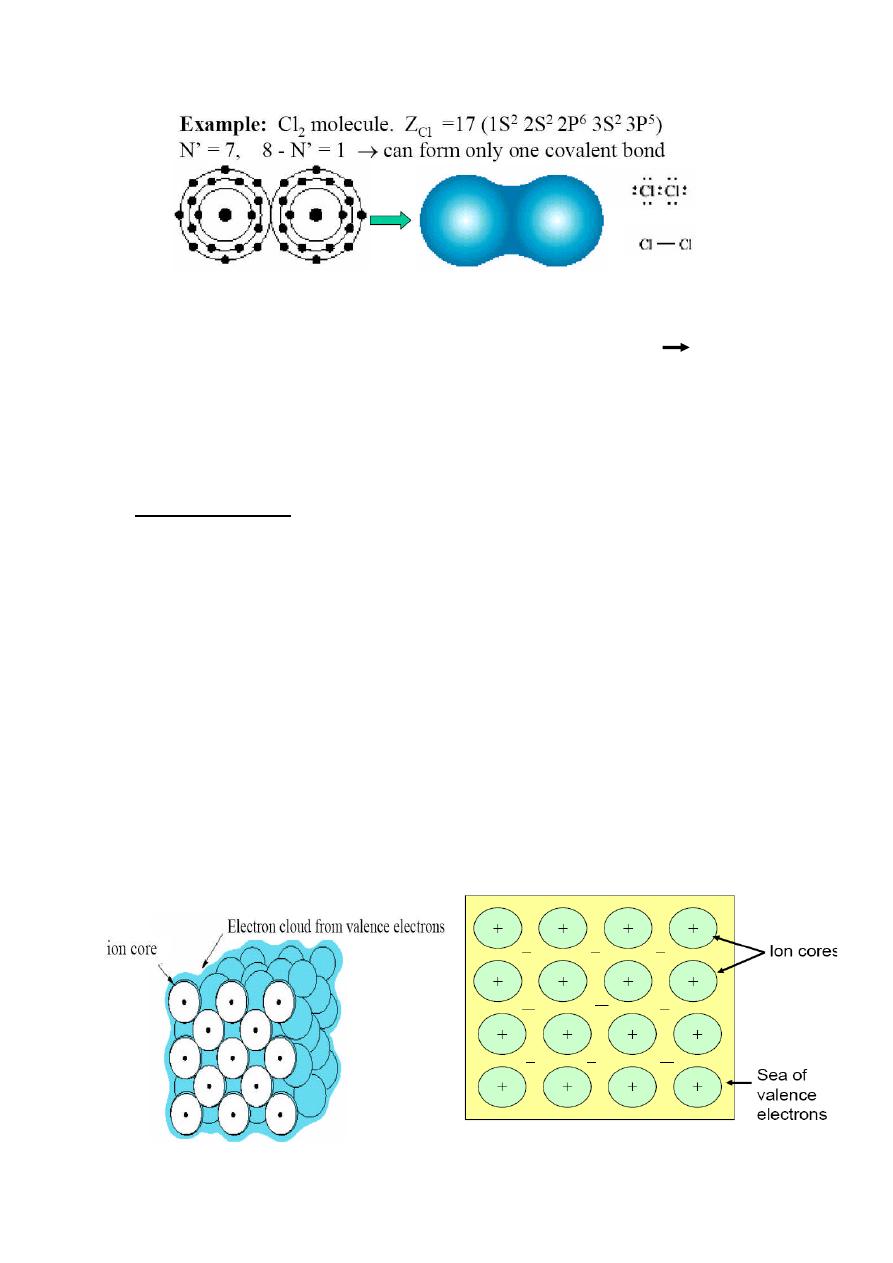
Covalent Bonding
In covalent bonding stable electron configurations are assumed by sharing of
electrons between adjacent atoms.
Two atoms that are covalently bonded will each contribute at least one
electron to the bond, and the shared electrons may be considered to belong to
both atoms.
Many nonmetallic elemental molecules (H
2
, Cl
2
, F
2
, etc)
Molecules containing dissimilar atoms (CH
4
, H
2
O, HNO
3
, HF, etc)
Other elemental solids: diamond (carbon), silicon, germanium
Other solid compounds composed (GaAs, InSb, SiC)
Number of covalent bonds in an atom is determined by number of valence
electron.
N’ valence electron
an atom can covalently bond with at most 8-N’ other
atoms
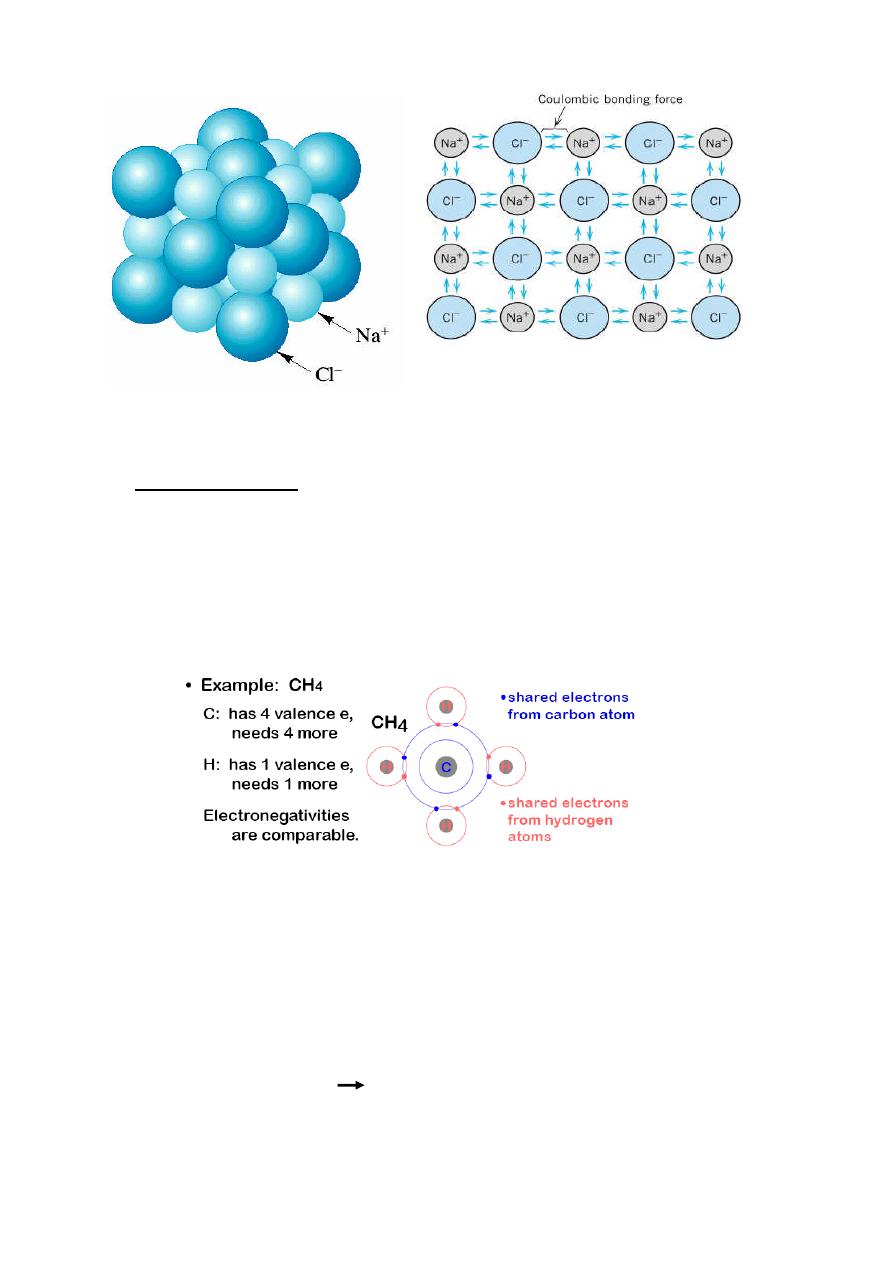
Schematic
representation
of
ionic
bonding in sodium chloride(NaCl)
Lecture 2
Atomic structure and interatomic bonding
6
Highly directional type of bonding.
Binding energy & melting temp for covalently bonded materials
very high
(diamond) to very weak (bismuth, polymeric material)
Very few compounds exhibit pure covalent bonding (or ionic bonding).
Possible of having interatomic bonds (partially ionic and partially covalent).
Metallic Bonding
Valence electrons are detached from atoms, and spread in an 'electron sea' that "glues"
the positive ions together.
• A metallic bond is non-directional (bonds form in any direction) → atoms pack
closely
• The “bonds” do not “break” when atoms are rearranged – metals can experience a
significant degree of plastic deformation.
• Binding energy & melting temp (wide range)
• All elemental metals, highly conductive, Ductile.
• Examples of typical metallic bonding: Cu, Al, Au, Ag, etc. Transition metals (Fe,
Ni, etc.) form mixed bonds that are comprising of metallic bonds and covalent bonds
involving their 3d-electrons. As a result the transition metals are more brittle (less
ductile) that Au or Cu.
Schematic illustration of metallic bonding
Lecture 2
Atomic structure and interatomic bonding
7
Secondary Bonds
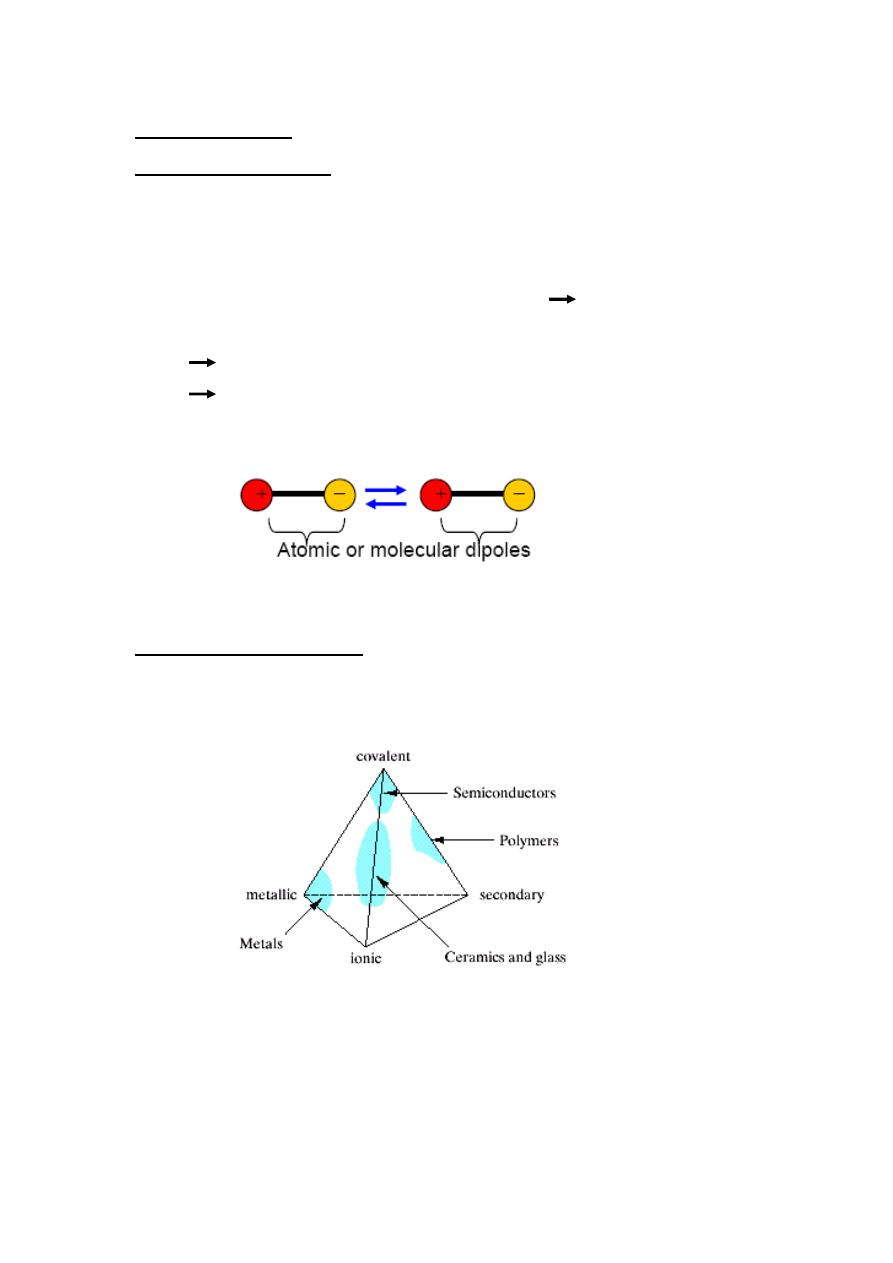
Van der Waals Bonds
Van der Waals bond or physical bond
Exist between virtually all atoms or molecules.
The presence of any of the 3 primary bonding types may obscure it.
This force arises from atomic or molecular dipoles
electric dipoles.
Electric dipoles
Separation of positive and negative portions of an atom or molecule
Coulombic attraction between +ve end of one dipole and –ve end dipole.
Schematic illustration of van der Waals bonding between two dipoles
Bonding in real materials
In many materials more than one type of bonding is involved (ionic and covalent in
ceramics, covalent and secondary in polymers, covalent and ionic in semiconductors.
Lecture 2
Atomic structure and interatomic bonding
8
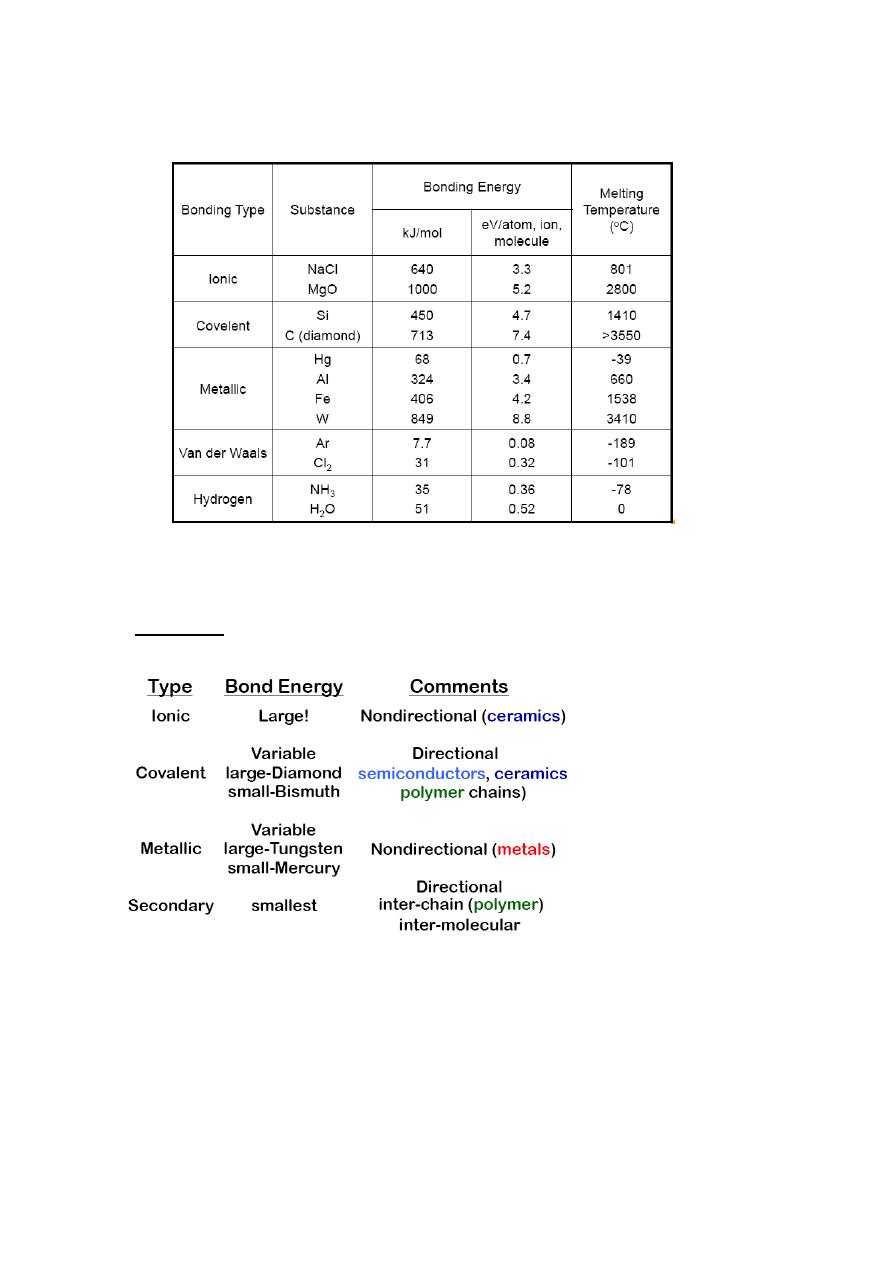
Summary
Correlation between bonding energy and melting temperature
